题目内容
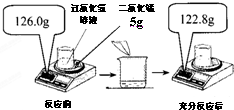 张玉同学在实验室发现了一瓶敞口放置的过氧化氢溶液,他认为该溶液中溶质的质量分数减小了,需要重新测定并更换试剂瓶的标签.他取该溶液34.0g倒入烧杯中,然后进行了如图所示的实验.
张玉同学在实验室发现了一瓶敞口放置的过氧化氢溶液,他认为该溶液中溶质的质量分数减小了,需要重新测定并更换试剂瓶的标签.他取该溶液34.0g倒入烧杯中,然后进行了如图所示的实验.(1)该溶液溶质的质量分数减小的理由是
溶液中过氧化氢在常温下能缓慢分解成水和氧气
溶液中过氧化氢在常温下能缓慢分解成水和氧气
(2)充分反应后,烧杯中二氧化锰的质量为
5
5
g,依据是催化剂在化学反应前后质量不变
催化剂在化学反应前后质量不变
.(3)充分反应后,生成的气体的质量为
3.2
3.2
g,依据是质量守恒定律
质量守恒定律
.(4)计算该瓶溶液中溶质的质量分数.
分析:依据过氧化氢的性质以及质量守恒定律和化学方程的有关计算分析解答;
解答:解:(1)由于溶液中过氧化氢在常温下能缓慢分解成水和氧气,所以该溶液溶质的质量分数会减小;
(2)由于二氧化锰是该反应的催化剂,催化剂在化学反应前后质量不变.所以二氧化锰的质量会是5g;
(3)依据质量守恒定律可知反应前后的质量差即为生成的氧气的质量,所以生成氧气的质量是126.0g-122.8g=3.2g;
(4)设产生3.2g氧气需要过氧化氢的质量为x
2H2O2
2H2O+O2↑
68 32
x 3.2g
=
x=6.8g
此过氧化氢溶液中溶质的质量分数为
×100%=20%
故答为:(1)溶液中过氧化氢在常温下能缓慢分解成水和氧气;(2)5,催化剂在化学反应前后质量不变.(3)3.2,质量守恒定律.(4)该瓶溶液中溶质的质量分数为20%.
(2)由于二氧化锰是该反应的催化剂,催化剂在化学反应前后质量不变.所以二氧化锰的质量会是5g;
(3)依据质量守恒定律可知反应前后的质量差即为生成的氧气的质量,所以生成氧气的质量是126.0g-122.8g=3.2g;
(4)设产生3.2g氧气需要过氧化氢的质量为x
2H2O2
| ||
68 32
x 3.2g
| 68 |
| x |
| 32 |
| 3.2g |
x=6.8g
此过氧化氢溶液中溶质的质量分数为
| 6.8g |
| 34.0g |
故答为:(1)溶液中过氧化氢在常温下能缓慢分解成水和氧气;(2)5,催化剂在化学反应前后质量不变.(3)3.2,质量守恒定律.(4)该瓶溶液中溶质的质量分数为20%.
点评:在解此类题时,首先利用质量守恒定律解出氧气的质量,然后利用方程式中的比例关系解出需要求解的物质的质量.

练习册系列答案
相关题目