题目内容
【题目】有等质量的镁和铁,二者都放入质量分数为10%的稀硫酸中,产生氢气的质量随时间变化曲线如图所示.下列说法错误的是
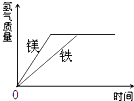
A.反应后镁有剩余 B.消耗的稀硫酸质量相等
C.反应后铁有剩余 D.产生氢气的质量相等
【答案】C
【解析】A、通过图象可以看出,两种金属与酸反应生成的氢气质量相等,但是依据化学方程式可知,生成等质量的氢气,使用的镁的质量少,所以反应后镁有剩余,故A正确;
B、依据质量守恒定律可知,生成氢气的氢元素全部来自稀硫酸,生成氢气质量相等,所以消耗的稀硫酸质量相等,故B正确;
C、通过图象可以看出,两种金属与酸反应生成的氢气质量相等,但是依据化学方程式可知,生成等质量的氢气,使用的镁的质量少,所以反应后只有铁剩余是不可能的,故C错误;
D、通过图象可以看出,两种金属与酸反应生成的氢气质量相等,故D正确.
故选:C.

练习册系列答案
相关题目




