题目内容
【题目】将锌和硫酸锌的混合物10.4克,加入89.8克稀硫酸中,具体反应流程如下:
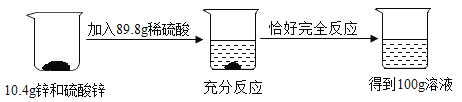
请根据上述内容回答下列问题:
(1)写出反应化学方程式____________________________
(2)根据已知条件写出求原混合物中锌的质量(X)的比例式________
(3)在原混合物中锌与硫酸锌的最简质量比为______________。
(4)反应后溶液中溶质的质量分数为___________________。
(5)上述稀硫酸是由98%的浓硫酸稀释得到的,在配制时所加水的质量为__________。
【答案】![]()
![]() 65:39 20% 79.8g
65:39 20% 79.8g
【解析】
锌和硫酸锌只有锌和硫酸反应生成硫酸锌和氢气;根据质量守恒定律可求反应前后的质量变化为生成的氢气的质量,可得氢气的质量,进而求算锌、硫酸和硫酸锌的质量,进而继续按照题目要求计算。
(1)锌和硫酸反应生成硫酸锌和氢气,对应的化学方程式为![]() ;
;
(2)(3)根据质量守恒定律可求反应前后的质量变化为生成的氢气的质量,氢气的质量为10.4g+89.8g-100g=0.2g。
设参加反应的锌的质量为x,H2SO4的质量为y,生成的硫酸锌的质量为z
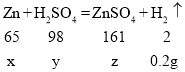
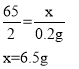
![]()
y=9.8g
z=16.1g
则原混合物中锌和硫酸锌的质量比为6.5g:(10.4g-6.5g)=65:39;
(4)反应后所得溶液中硫酸锌的质量分数为![]() 。
。
(5)所用浓硫酸的质量![]() ,而所得溶液为89.8g,所以加水的质量为89.8g-10g=79.8g。
,而所得溶液为89.8g,所以加水的质量为89.8g-10g=79.8g。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目