题目内容
【题目】下图是对生成氯化钠反应关系的归纳与整理。
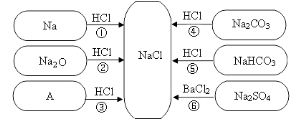
(1)物质A 是常见的碱,写出A 的化学式: 。
(2)反应④的类型为: _______ ___ 。
(3)说出NaHCO3在医疗上的一种用途:___________________________ 。
(4)反应③、④、⑤、⑥能够进行的原因是___________________________ 。
(5)实验室配制200g 8 %的NaCl 溶液,需要水的质量是________g ,配制过程中为了加快NaCl 的溶解,可以采取的措施是___________________________ 。
【答案】NaOH 复分解 治疗胃酸过多 有气体或沉淀或水生成 184g 用玻璃棒搅拌
【解析】
试题分析:(1)能与盐酸反应生成氯化钠的碱需含有钠元素,那么为该碱为氢氧化钠;(2)Na2CO3+2HCl === 2NaCl+H2O+CO2↑,为两种化合物两两交换成分生成新的两种化合物,属于复分解反应;(3)碳酸氢钠具有弱碱性能中和酸性,医疗上可用于治疗胃酸过多;(4)③、④、⑤、⑥都为复分解反应,有气体二氧化碳或有水或有沉淀硫酸钡生成,可以发生;(5)需要水的质量=200×(100%-8%)=184g;可以通过搅拌加速氯化钠的分散,使其快速溶解

 阅读快车系列答案
阅读快车系列答案【题目】为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定了反应后溶液的pH,得到了如下图所示的pH曲线,请回答:
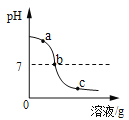
(1)由图可知该实验操作是将__________滴加到另一种溶液中;
(2)该反应的化学方程式为___________;
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液。
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl。
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现___________的现象。结论:该样品是a处溶液。
②为进一步确定b或c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液。 | ________ | 该样品为b处溶液。 |
【反思评价】探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑____________。