题目内容
【题目】A、B两种微粒结构示意图如图所示.根据图示回答下列问题:
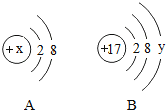
(1)若A是阴离子,则x可能是下列中的 ______ .(填选项字母)
a.8b.10c.11d.12
(2)若B是原子,则y= ______ ,与铝形成的化合物的化学式为 ______ .
(3)若A、B均为原子,则能形成AB2型化合物吗? ______ (填“能”或“不能”).
【答案】 a 7 AlCl3 不能
【解析】原子得失电子形成离子。最外层电子数小于4时原子容易失电子形成带正电荷的阳离子,最外层电子数大于4时容易得到电子形成带负电荷的阴离子。(1)若A是阴离子,那么它的原子的最外层电子数大于4,X可能是7、8、9,故选a;(2)在原子中,质子数=核外电子数。若B是原子,那么y=17-10=7;质子数为17的是氯元素,显-1价,铝元素显+3价。根据化合物的化学式的写法:正价在左,负价在右,正负化合价代数和为0的原则,可知氯化铝表示为AlCl3;(3)若A、B均为原子,那么A是氖原子,氖元素是稀有气体元素,它的最外层电子数为8,属稳定结构,故不能与B形成化合物。
点睛:在原子中,质子数=核外电子数;阳离子中,质子数>核外电子数;阴离子中,质子数<核外电子数。

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
【题目】以下4个图象,能正确反映对应关系的是( )
A | B | C | D |
利用红磷燃烧测定空气中氧气的含量(打开止水夹前) | 加热一定质量高锰酸钾固体 | 木炭在盛有氧气的密闭容器内燃烧 | 甲醛和过量的氧气在密闭容器中完全反应 |
|
|
|
|
A. A B. B C. C D. D








