题目内容
某研究小组为验证铁、铜、锌、银的金属活动顺序,设计如图所示三个实验(三种金属已用砂纸打磨过,其形状和大小相同,稀盐酸的浓度和用量也相同)。
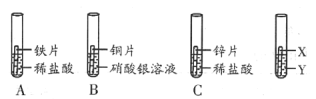
(1)实验前用砂纸打磨金属的目的是________________。
(2)一段时间后,观察到实验B的铜片表面有银白色固体附着,且溶液由无色变为______色,这说明铜比该金属活动性_______(填“强” 或“弱”),该反应的化学方程式为___________。
(3)甲同学认为通过实验A和C可比较锌和铁的金属活动性,他依据的实验现象是_________。
(4)乙同学认为仅仅通过上述实验不足以得出四种金属的活动性顺序,因此在上述实验的基础上,乙同学又补做了一个实验,装置如图所示,且实现了探究目的。乙同学的实验:X是金属______,Y是__________溶液。
 名校课堂系列答案
名校课堂系列答案同学们在课外学习活动中知道了钠和镁着火不能用CO2来灭火。他们通过查阅资料发现Mg能在CO2中燃烧:2Mg+CO2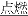 2MgO+C,但没有找到有关钠能否与CO2反应的介绍.有同学认为钠能发生类似于CO2与镁的反应,可能的化学方程式为_______________。
2MgO+C,但没有找到有关钠能否与CO2反应的介绍.有同学认为钠能发生类似于CO2与镁的反应,可能的化学方程式为_______________。
于是同学们展开了以下探究:
[实验]将燃着的钠伸入装有干燥的CO2的集气瓶中,钠能在CO2中继续燃烧。
[查阅资料]Na2O是白色固体,能与CO2反应生成Na2CO3,与H2O反应生成NaOH。
[提出猜想]同学们认为钠在CO2中燃烧的产物应该与Mg在CO2中燃烧的产物情况有所不同,并对产物提出了以下凡种猜想:通过理论分析,猜想________(填序号)肯定是错误的,理由是:______________________________________。
[验证猜想]①Na2O、C ②________、C ③NaOH、C ④Na2O、Na2CO3、C
通过理论分析,猜想________(填序号)肯定是错误的,理由是:__________________。
[验证猜想]
步骤 | 实验操作 | 主要实验现象 | 结论(燃烧产物判断) |
(1) | 将产物溶于适量水中 | 部分溶解,试管底部有黑色固体 | 燃烧产物中肯定有___ |
(2) | 取(1)所得少量上层清液,加入过量的BaCl2溶液 | _________________ | 燃烧产物中肯定有Na2CO3 |
(2) | 取(2)所得少量上层清液,加入_____溶液 | 溶液变成红色 | 燃烧产物中肯定有___ |
在步骤(2)中BaCl2溶液加入至过量的目的是____________________________________。
在步骤(3)中也可以通过加入的________方法进行检验(任写一种试剂)
[结论]猜想________(填序号)正确。


 _________ ________________
_________ ________________ 向一定量的AgNO3和Cu(NO3)2的混合溶液中不断加入铁粉
向一定量的AgNO3和Cu(NO3)2的混合溶液中不断加入铁粉 室温下,向一定质量的饱和石灰水中加生石灰
室温下,向一定质量的饱和石灰水中加生石灰 常温下,向pH=10的NaOH溶液中不断加入水稀释
常温下,向pH=10的NaOH溶液中不断加入水稀释 足量的镁、铁与等质量、等质量分数的稀盐酸充分反应
足量的镁、铁与等质量、等质量分数的稀盐酸充分反应