题目内容
已知相对原子质量:Li 为6.9;Na 为23;K为39;Rb 为85.今有某碱金属M及其氧化物M2O组成的混合物10.8g,加足量水充分反应后,溶液经蒸发和干燥得固体16g.据此可确定金属M为何种元素?(提示:2M+2H2O═2MOH+H2↑)
【答案】分析:解答本题关键是取极值法:假设10.8g全部是碱金属M,根据生成碱的质量,通过方程式列出比例式,计算M的相对原子质量,再假设10.8g全部是氧化物M2O根据生成碱的质量,通过方程式列出比例式,计算M的相对原子质量.
解答:解:设金属M的相对原子质量为a,若10.8g混合物全为M,由M~MOH的关系可知:可产生MOH的质量为10.8× g,若10.8g混合物全为M2O,则有:
g,若10.8g混合物全为M2O,则有:
M2O~2MOH
2a+16 2(a+17)
可知产生MOH的质量为了10.8× g<16g<10.8×
g<16g<10.8× g,即:
g,即: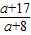 <
<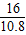 g<
g< g
g
为计算方便取为 为
为  ,代入不等式,解得:10.7<a<35.3,因此M为Na元素(相对原子质量为23)
,代入不等式,解得:10.7<a<35.3,因此M为Na元素(相对原子质量为23)
故答案为:钠元素
点评:解答本题的关键是利用极值法进行分析,解出相对原子质量的取值范围,再进行判断.
解答:解:设金属M的相对原子质量为a,若10.8g混合物全为M,由M~MOH的关系可知:可产生MOH的质量为10.8×
 g,若10.8g混合物全为M2O,则有:
g,若10.8g混合物全为M2O,则有:M2O~2MOH
2a+16 2(a+17)
可知产生MOH的质量为了10.8×
 g<16g<10.8×
g<16g<10.8× g,即:
g,即: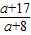 <
<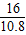 g<
g< g
g为计算方便取为
 为
为  ,代入不等式,解得:10.7<a<35.3,因此M为Na元素(相对原子质量为23)
,代入不等式,解得:10.7<a<35.3,因此M为Na元素(相对原子质量为23)故答案为:钠元素
点评:解答本题的关键是利用极值法进行分析,解出相对原子质量的取值范围,再进行判断.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
已知每个电子的质量约为每个质子(或中子)质量的1/1836。下表是有关于原子的一些信息。通过此表,可总结出“在原子里质子数等于电子数”,你还能总结出哪些信息:
| 原子种类 | 质子数 | 中子数 | 核外电子数 | 相对原子质量 |
| 氢 | l | 0 | 1 | 1 |
| 碳 | 6 | 6 | 6 | 12 |
| 氧 | 8 | 8 | 8 | 16 |
| 钠 | 11 | 12 | 11 | 23 |
| 铁 | 26 | 30 | 26 | 56 |
⑴ ;
⑵ ;
⑶ ;
⑷ 。
 今年世界环境日的主题是“营造绿色城市,呵护地球家园”.某科学探究小组为探究影响大气“温室效应”的因素,进行太阳光照射下N2、O2、CO2及空气温室效应强度的比较实验.请你参与他们的探究过程,填写有关空格.
今年世界环境日的主题是“营造绿色城市,呵护地球家园”.某科学探究小组为探究影响大气“温室效应”的因素,进行太阳光照射下N2、O2、CO2及空气温室效应强度的比较实验.请你参与他们的探究过程,填写有关空格. 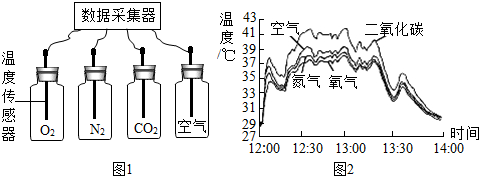
 (1)已知一个锶原子的质量是8.304×10 -26kg,一种碳-12原子一个质量为1.993×10 -26kg,则锶原子相对原子质量是多少?(结果保留整数)
(1)已知一个锶原子的质量是8.304×10 -26kg,一种碳-12原子一个质量为1.993×10 -26kg,则锶原子相对原子质量是多少?(结果保留整数)

 ”.然而化学方程式中最后一种物质的化学式印刷不清楚,根据上下文了解到该物质是一种酸,请根据已学知识推测其化学式:
”.然而化学方程式中最后一种物质的化学式印刷不清楚,根据上下文了解到该物质是一种酸,请根据已学知识推测其化学式:

 +H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:
+H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式: