题目内容
 (2008?新疆)取一定质量分数的氯化钠溶液117克进行电解,反应的化学方程式为:2NaCl+2H2O
(2008?新疆)取一定质量分数的氯化钠溶液117克进行电解,反应的化学方程式为:2NaCl+2H2O
| ||
请计算:
(1)当氯化钠完全反应时,生成氢气多少克?
(2)所取氯化钠溶液的质量分数.
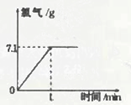
分析:(1)根据图示可知生成氯气质量为7.1g,再根据氯气的质量计算出生成氢气的质量;
(2)根据氯气的质量计算出氯化钠的质量,再用氯化钠的质量除以117g乘以百分之百.
(2)根据氯气的质量计算出氯化钠的质量,再用氯化钠的质量除以117g乘以百分之百.
解答:解:(1)根据图示可知生成氯气质量为7.1g,设要生成7.1g氯气需要参加反应的氯化钠的质量为x,生成氢气质量为y则:
2NaCl+2H2O
2NaOH+Cl2↑+H2↑
117 71 2
x 7.1g y
根据:
=
解得x=11.7g,
根据:
=
解得y=0.2g,所以生成氢气质量为0.2g;
(2)所取氯化钠溶液的质量分数:
×100%=10%.
故答案为:
(1)0.2g;
(2)10%.
2NaCl+2H2O
| ||
117 71 2
x 7.1g y
根据:
| 117 |
| 71 |
| x |
| 7.1g |
根据:
| 71 |
| 2 |
| 7.1g |
| y |
(2)所取氯化钠溶液的质量分数:
| 11.7 |
| 117 |
故答案为:
(1)0.2g;
(2)10%.
点评:解答本题的关键是要通过图示知道生成氯气质量为7.1g,再根据方程式求其它物质质量即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目