题目内容
酸和碱能发生中和反应,它在日常生活和工农业生产中有广泛的应用.小强同学在做中和反应实验时,向盛有40g10%的氢氧化钠溶液的烧杯中逐滴加入稀盐酸,当恰好完全反应时,共滴加了36.5g稀盐酸.(结果保留小数点一位)
(1)配制40g10%的氢氧化钠溶液需要水 mL.(ρ水=1.0g/mL)
(2)求:所加稀盐酸的溶质质量分数和反应后所得溶液中溶质的质量分数.
(1)配制40g10%的氢氧化钠溶液需要水
(2)求:所加稀盐酸的溶质质量分数和反应后所得溶液中溶质的质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)由氢氧化钠溶液的质量和溶质质量分数可以计算出溶液中溶剂的质量.
(2)由氢氧化钠溶液的质量和溶质质量分数、稀盐酸的质量,根据化学方程式可以计算出稀盐酸的溶质质量分数和所得溶液中溶质的质量分数.
(2)由氢氧化钠溶液的质量和溶质质量分数、稀盐酸的质量,根据化学方程式可以计算出稀盐酸的溶质质量分数和所得溶液中溶质的质量分数.
解答:解:(1)需要水的体积为
40g×(1-10%)÷1.0g/mL=36mL
故填:36;
(2)设稀盐酸中溶质的质量分数为x,反应生成的NaCl的质量为y
NaOH+HCl=NaCl+H2O
40 36.5 58.5
40g×10% 36.5g×x y
=
,
=
,
x=10%,y=5.85g
反应后所得溶液中溶质的质量分数:
×100%=7.6%
答:所加稀盐酸的溶质质量分数为10%;反应后所得溶液中溶质的质量分数为7.6%.
40g×(1-10%)÷1.0g/mL=36mL
故填:36;
(2)设稀盐酸中溶质的质量分数为x,反应生成的NaCl的质量为y
NaOH+HCl=NaCl+H2O
40 36.5 58.5
40g×10% 36.5g×x y
| 40 |
| 40g×10% |
| 36.5 |
| 36.5g×x |
| 40 |
| 40g×10% |
| 58.5 |
| y |
x=10%,y=5.85g
反应后所得溶液中溶质的质量分数:
| 5.85g |
| 40g+36.5g |
答:所加稀盐酸的溶质质量分数为10%;反应后所得溶液中溶质的质量分数为7.6%.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
下列各组概念中,前者一定包含后者的是( )
| A、纯净物混合物 |
| B、化学变化物理变化 |
| C、氧化反应化合反应 |
| D、化学反应分解反应 |
下列说法正确的是( )
| A、二氧化碳和一氧化碳都可使澄清的石灰水变浑浊 |
| B、碳在常温下化学性质活泼 |
| C、二氧化碳可使紫色石蕊溶液变蓝 |
| D、温室效应为人类提供了适宜的生存温度 |
用数轴表示某些化学知识直观、简明、易记.下列数轴表示错误的是( )
A、银、铜、铁的金属活动性强弱: |
B、根据铁的含碳量,将其分成生铁和钢: |
C、物质形成溶液的pH: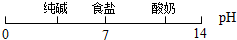 |
D、氮气、及其化合物与化合价的关系: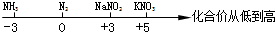 |
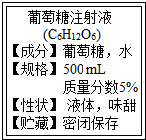 如图是某输液瓶标签上的部分内容,请回答:
如图是某输液瓶标签上的部分内容,请回答:
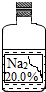 在一次趣味化学活动中,老师向同学们展示了一瓶标签受损的无色溶液,如图所示,要求同学们进行探究:确认这瓶无色溶液是什么?
在一次趣味化学活动中,老师向同学们展示了一瓶标签受损的无色溶液,如图所示,要求同学们进行探究:确认这瓶无色溶液是什么?