题目内容
【题目】(7分)实验室有一瓶试剂的标签破损不清如下图,

甲、乙、丙三位同学对它的主要成分进行讨论,一起猜想。
甲同学认为:该试剂主要成分是酸;
乙同学认为:该试剂主要成分是碱;
丙同学认为:该试剂主要成分是盐;
(1)你认为 同学的猜想是错误的;
(2)丙同学证实该物质是一种氮肥,则化学式是 ;
(3)甲同学对有关盐的知识进行了以下的整理。
氯化钾 | 氯化钙 | 氯化钠 | 氯化镁 | 氯化铝 | 氯化锌 | 氯化亚铁 | 氯化铜 |
KCl | CaCl2 | NaCl | MgCl2 | AlCl3 | ZnCl2 | FeCl2 | CuCl2 |
反思:
①根据以上盐中的金属元素的排列,可以得出是依据 顺序归纳整理的。
②酸在水溶液中能解离出H+,因此酸溶液具有相似的化学性质。据此分析上述盐溶液也会具有相似的化学性质,写出一种与上述盐溶液均能发生反应的物质的名称: 。
(4)小组同学探究:除去固体氯化钠中混有的氯化钙。
设计实验方案如下,请参与实验并回答问题。
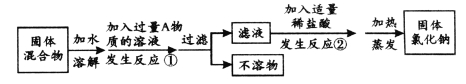
a.写出A物质的化学式: ;
b.反应②中如果加入的稀盐酸也过量,则对所得到的氯化钠纯度 (选填“有”或“没有”)影响;
c.分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果 (选填“不变”、“增大”或“减小”)。
【答案】(1)乙 (2)NH4CL (3)①②金属活动性 ②硝酸银
(4)a.Na2CO3 b.没有 c.增大
【解析】
试题分析:(1)碱由金属离子和氢氧根离子构成,该物质中含有氯离子,故不可能是碱;
(2)氮肥是含有氮元素的化合物,该物质中含有氯离子,氯离子显+1价,故可能是氯化铵;
(3)由物质的名称可知,这些盐是按金属活动性的顺序排列的;根据复分解反应发生的条件生成物中有水、气体或沉淀生成才能发生,这些盐中均含有氯离子,盐酸盐中只有氯化银难溶于水,故可加入硝酸银;
(4)除去固体氯化钠中混有的氯化钙,可先加上溶解后加入过量的碳酸钠溶液,是氯化钙转化为碳酸钙沉淀除去,在向溶液中加入稀盐酸,稀盐酸与碳酸钠反应会生成氯化钠、水和二氧化碳,最后蒸发即能得到氯化钠固体。