题目内容
把5.1g镁和铝的合金加入到一定质量、一定质量分数的稀盐酸中,恰好完全反应,产生O.5g氢气.向反应后的溶液中加入一定量的NaOH溶液,恰好使上述产生的氯化镁、氯化铝完全转化为沉淀,则生成的氯化钠的质量为( )
| A、12.25g |
| B、29.25g |
| C、30.5g |
| D、20.25g |
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:根据题意可知,生成的氯化钠中的氯元素全部来自于与5.1g合金反应所消耗的盐酸,因此,计算出所消耗盐酸中的氯元素质量即为最终生成氯化钠中氯元素质量,再利用氯化钠中氯元素的质量分数,即可计算出最终生成氯化钠的质量.
解答:解:与5.1g镁铝合金反应的盐酸的质量=0.5g÷
=18.25g
18.25gHCl中Cl元素的质量=18.25g×
=17.75g
含17.75gCl的NaCl的质量=17.75g÷
=29.25g
故选B
| 1 |
| 36.5 |
18.25gHCl中Cl元素的质量=18.25g×
| 35.5 |
| 36.5 |
含17.75gCl的NaCl的质量=17.75g÷
| 35.5 |
| 58.5 |
故选B
点评:解决本题的技巧在于发现最终生成的氯化钠中氯元素全部来自于与镁铝合金发生反应的盐酸,这样就把看似无法解决的化学方程式的计算转变为根据化学式的计算,从而巧妙地解决问题.

练习册系列答案
相关题目
2012年2月,国务院发布了新的《环境空气质量标准》,下列项目不必列入监测范围的是( )
| A、氮气 | B、二氧化硫 |
| C、一氧化碳 | D、PM2.5 |
如图是a、b、c三种固体物质的溶解度曲线,下列叙述正确的是( )


| A、若t1℃为20℃,则c是可溶于水的物质 |
| B、t2℃时30g物质a加入到50g水中不断搅拌,形成80g溶液 |
| C、将a、b、c三种物质t1℃时的饱和溶液升温至t2℃,所得溶液的溶质质量分数大小关系是a>b>c |
| D、若a中混有少量c,可以采用冷却热饱和溶液的方法提纯a |
 要使图中的小气球鼓起来,则使用的固体和液体可以是( )
要使图中的小气球鼓起来,则使用的固体和液体可以是( )(1)氢氧化钠和水 (2)碳酸钠和稀盐酸
(3)氯化钠和水 (4)生石灰和水.
| A、(1)(2)(3)(4) |
| B、(1)(2) |
| C、(1)(2)(4) |
| D、(2) |
在反应3CO+Fe2O3
2Fe+3CO2所提供的信息中,正确的是( )
①每84份质量的一氧化碳恰好与160份质量的三氧化二铁完全反应,生成112份质量的铁与132份质量的二氧化碳②反应条件是高温③反应前后原子个数不变 ④反应前后物质种类没变 ⑤反应前后元素种类没有改变.
| ||
①每84份质量的一氧化碳恰好与160份质量的三氧化二铁完全反应,生成112份质量的铁与132份质量的二氧化碳②反应条件是高温③反应前后原子个数不变 ④反应前后物质种类没变 ⑤反应前后元素种类没有改变.
| A、②③④⑤ | B、①③④⑤ |
| C、①②③④ | D、①②③⑤ |
下列物质用途错误的是( )
A、 用活性炭填充防毒面具的滤毒罐 |
B、 完全用金属制自行车 |
C、 用黄金做首饰 |
D、 用沼气做燃料 |
下列物质属于纯净物的是( )
| A、浑浊的空气 |
| B、清新的空气 |
| C、无色透明的雪碧饮料 |
| D、蒸馏水 |
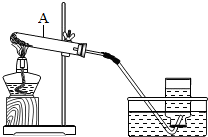 如图是某同学正在绘制的实验室用高锰酸钾制取氧气的装置图.请回答下列问题:
如图是某同学正在绘制的实验室用高锰酸钾制取氧气的装置图.请回答下列问题: