题目内容
【题目】分析如图,回答问题。
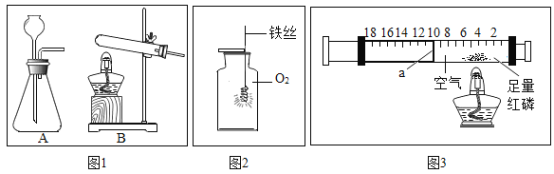
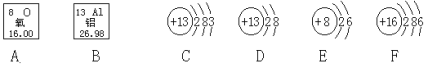
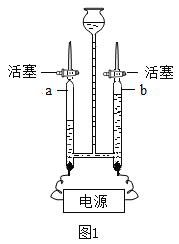
实验室用二氧化锰和氯酸钾制取氧气时,发生装置可以选用图1中装置_________(填字母序号),二氧化锰作该反应的_____________。用图2的装置进行铁丝在O2中燃烧的实验,容易导致集气瓶炸裂,为了避免这种情况,应采取的措施是______________。如图3所示,红磷用酒精灯加热后燃烧,燃烧的现象是_______________;红磷燃烧后冷却至室温,活塞a停在刻度______________(填数字)处;红磷燃烧的文字表达式为_______________。
【答案】B 催化剂 在集气瓶底部放少量水或细沙 产生大量的白烟,放出大量的热,生成一种白色固体 8 ![]()
【解析】
氯酸钾和二氧化锰加热生成氯化钾和氧气,铁丝在氧气中点燃生成四氧化三铁,红磷燃烧生成五氧化二磷。
氯酸钾和二氧化锰加热生成氯化钾和氧气,实验室用二氧化锰和氯酸钾制取氧气时,发生装置可以选用图1中装置B,二氧化锰作该反应的催化剂。铁丝在氧气中点燃放出大量热,生成高温熔融物,故用图2的装置进行铁丝在O2中燃烧的实验,容易导致集气瓶炸裂,为了避免这种情况,应采取的措施是在集气瓶底部放少量水或细沙。红磷用酒精灯加热后燃烧,燃烧的现象是产生大量的白烟,放出大量的热,生成一种白色固体;氧气约占空气总体积的五分之一,红磷燃烧后冷却至室温,消耗的氧气的体积为![]() ,故活塞a停在刻度8处;红磷燃烧的文字表达式为
,故活塞a停在刻度8处;红磷燃烧的文字表达式为![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】同学们在学习完氧气的性质后,知道了“氧气能使带火星的木条复燃”,在此基础上,同学们提出了以下问题,并逐一进行了探究。
(1)(问题一)带火星的木条复燃能否证明氧气是纯氧?
(进行实验)同学们用数字化实验探测仪进行实验![]() 如图
如图![]() ,并获得了一系列数据。
,并获得了一系列数据。
集气瓶编号 | ① | ② | ③ | ④ | ⑤ |
氧气浓度(体积分数) | 25% | 35% | 45% | … | 65% |
带火星木条情况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 |
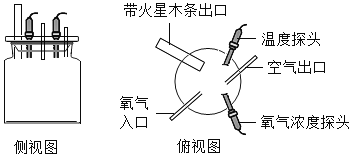
(收集证据)④号集气瓶内的氧气浓度可能是_____。
(实验结论)_____。
(反思与评价)分析以上数据可知欲收集瓶较为纯争的氧气最好的收集方法是_____。
(2)(问题二)铁丝在氧气中的燃烧与氧气浓度和铁丝粗细有关系吗?
实验编号 | ① | ② | ③ | ④ | ⑤ |
氧气浓度(体积分数) | 34% | 47% | 60% | 73% | 86% |
直径0.2mm的细铁丝 | 不燃烧 | 稍有燃烧 | 剧烈燃烧 | 剧烈燃烧 | 剧烈燃烧 |
直径0.5mm的粗铁丝 | 不燃烧 | 不燃烧 | 不燃烧 | 稍有燃烧 | 剧烈燃烧 |
(收集证据)⑤号实验中细铁丝燃烧的完整实验现象是_____。
(实验解释)有关反应的化学方程式是_____,实验操作中,在集气瓶底部放少量水的目的是_____。
(实验结论)Ⅰ![]() 氧气浓度越大,铁丝燃烧越_____。Ⅱ_____。
氧气浓度越大,铁丝燃烧越_____。Ⅱ_____。
(表达与交流)在完成铁丝燃烧的实验时,为保证实验成功需注意的一项实验操作是_____。
【题目】在日常生活和工农业生产中,溶液有着广泛的应用。
I.在农业上通常用12%的氯化钠溶液选种。实验室欲配制该质量分数的溶液60g,操作如下图,请回答下列问题:
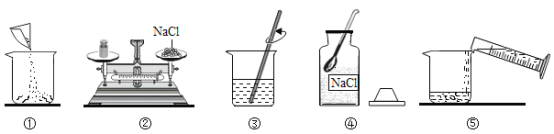
(1)请用图中的序号表示配制溶液的正确操作顺序____________。
(2)认真观察②,改正其中的错误操作:_______________。若不进行改正,其他操作步骤正确,则所配溶液的溶质的质量分数_________(填“大于”“小于”或“等于”)10%。
(3)若配制所得的氯化钠溶液溶质质量分数偏小,可能的原因是_________。
A 用量筒量取水时俯视读数
B 烧杯用蒸馏水润洗后未等晾干就配制溶液
C 天平指针偏右就开始称量
D 转移已配好的溶液时,有少量溶液溅出
E 转移已称好的氯化钠固体时,部分洒落在烧杯外
II.我们知道“海水制碱”工业用到的是饱和食盐水,医疗上使用的则是0.9%的生理盐水。请按要求设计并完成以下实验:
实验用品:氯化钠溶液、氯化钠、硝酸钾、蒸馏水、烧杯、试管、玻璃棒、药匙。
探究实验一:澄清透明的氯化钠溶液是否是饱和溶液
实验步骤 | 实验现象 | 实验结论 |
取一只试管倒入约5mL氯化钠溶液,用药匙加入少量氯化钠固体,振荡,观察现象。 | 氯化钠固体溶解 | _________ |
探究实验二:将不饱和氯化钠溶液变为饱和溶液并探究饱和氯化钠溶液还能否溶解硝酸钾固体
实验步骤 | 实验现象 | 实验结论 |
_________ | _________ | NaCl不饱和溶液变为饱和溶液 |
_________ | _________ | _________ |
请完成上面表格
【题目】某研究小组发现,将一片土豆片放入过氧化氢溶液中,过氧化氢溶液的分解速率加快。该小组同学进行了如下探究。
(提出问题)土豆能不能做过氧化氢分解的催化剂呢?
(作出猜想)土豆能做过氧化氢分解的催化剂。
(实验验证)
实验编号 | 实验操作 | 实验现象 |
① | 在试管中加入过氧化氢溶液,然后将带火星的木条伸入试管中 | 木条不复燃 |
② | 在装有过氧化氢溶液的试管中加入0.5 g土豆,然后将带火星的木条伸入试管中 | 产生大量的气泡,木条复燃 |
③ | 待②中反应结束,将试管里的剩余物进行过滤、洗涤、擦干、称量 | 称得固体质量为0.5 g |
④ | 将③中所得固体放入试管中,重新加入过氧化氢溶液,然后将带火星的木条伸入试管中 | 产生大量的气泡,木条复燃 |
(分析数据、得出结论)
(1)实验③证明土豆在反应前后________没有发生变化。
(2)实验④证明土豆在反应前后________没有发生变化。
结论:土豆可以做过氧化氢分解的催化剂。
(3)写出土豆做催化剂时过氧化氢分解的符号表达式__________。
(实验拓展)
(1)该研究小组又做了比较土豆与二氧化锰的催化效果的实验(如图)。实验时均以生成25 mL气体为准。其他可能影响实验的因素均忽略不计。
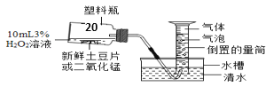
相关数据如下表:
实验编号 | 3%过氧化氢溶液体积 | 其他物质质量 | 待测数据 |
Ⅰ | 10 mL | 鲜土豆片0.5 g | a |
Ⅱ | 10 mL | 二氧化锰0.5 g | b |
①用量筒收集气体的优点____________。
②该实验还需控制的量有____________。
③上述实验中的“待测数据”指_________。
(2)研究小组继续开展“寻找过氧化氢分解的新催化剂”活动。小明用坩埚钳夹取一光亮的铜丝。放到酒精灯火焰上灼烧至表面变黑(此物质是氧化铜),然后迅速地插入一只装有10 m l 3%的过氧化氢溶液的试管中。观察到试管内迅速产生大量气泡。于是得出结论氧化铜可以加快过氧化氢的分解。小组同学认为这个结论不可靠。原因是使得过氧化氢分解速率加快的因素还可能与_______有关。请你重新设计实验方案__________。
(3)你能说出本题提到的影响催化剂的催化效果的因素是_________、_______。你知道还有_______、________也可以。