题目内容
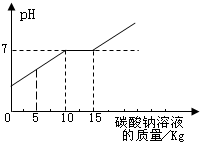 取盐酸与氯化钙的混合溶液11.88kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液.所得溶液pH与加入的碳酸钠溶液的质量关系如图所示
取盐酸与氯化钙的混合溶液11.88kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液.所得溶液pH与加入的碳酸钠溶液的质量关系如图所示(1)通过右图可知,当碳酸钠溶液质量加到
(2)溶液恰好完全反应时所得溶液中所含溶质氯化钠质量?
分析:(1)根据盐酸与氯化钙的混合溶液因盐酸溶液呈酸性、氯化钙溶液呈中性而使混合溶液呈酸性,溶液的pH小于7,碳酸钠溶液呈碱性,溶液的pH大于7;分析向混合溶液中不断加入碳酸钠时,溶液pH的变化与反应进行情况的关系,根据曲线判断恰好完全反应时滴加碳酸钠溶液的质量;
(2)根据两个反应后所得溶液均为氯化钠溶液,可利用反应生成氯化钠中钠元素与碳酸钠中钠元素质量相等,由碳酸钠的质量简单地计算出溶液恰好完全反应时生成氯化钠的质量.
(2)根据两个反应后所得溶液均为氯化钠溶液,可利用反应生成氯化钠中钠元素与碳酸钠中钠元素质量相等,由碳酸钠的质量简单地计算出溶液恰好完全反应时生成氯化钠的质量.
解答:解:(1)当反应后溶液的pH恰好等于7时,碳酸钠刚好与混合溶液中盐酸完全反应,之后滴加的碳酸钠继续与混合溶液中的氯化钙反应,至氯化钠也完全反应时,继续滴入的碳酸钠溶液使所得溶液pH开始再次改变而呈碱性,因此,所得溶液的pH开始大于7时为溶液恰好完全反应,由曲线可知此时所加碳酸钠溶液的质量为15kg;
(2)碳酸钠与盐酸及氯化钙完全反应都得到氯化钠溶液,完全反应所消耗碳酸钠溶液的质量为15kg,其中钠元素质量=15kg×21.2%×
×100%=1.38kg,
则溶液恰好完全反应时所得溶液中所含溶质氯化钠质量=1.38kg÷
×100%=3.51kg.
故答案为:15;3.51kg.
(2)碳酸钠与盐酸及氯化钙完全反应都得到氯化钠溶液,完全反应所消耗碳酸钠溶液的质量为15kg,其中钠元素质量=15kg×21.2%×
| 23×2 |
| 106 |
则溶液恰好完全反应时所得溶液中所含溶质氯化钠质量=1.38kg÷
| 23 |
| 58.5 |
故答案为:15;3.51kg.
点评:本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目


