题目内容
为了预防非典型肺炎,很多部门用过氧乙酸对环境进行消毒,已知过氧乙酸的化学式为C2H4O3.
(1)过氧乙酸的相对分子质量为 .C、H、O三种元素的质量比 .
(2)用百分比浓度为20%的过氧乙酸(密度为1.1克/厘米3),配制成百分比浓度为0.4%的过氧乙酸的消毒液(密度为1.0克/厘米3)15升,需要20%的过氧乙酸溶液体积是多少毫升?(最后结果保留一位小数)
(1)过氧乙酸的相对分子质量为
(2)用百分比浓度为20%的过氧乙酸(密度为1.1克/厘米3),配制成百分比浓度为0.4%的过氧乙酸的消毒液(密度为1.0克/厘米3)15升,需要20%的过氧乙酸溶液体积是多少毫升?(最后结果保留一位小数)
考点:相对分子质量的概念及其计算,有关溶质质量分数的简单计算,元素质量比的计算
专题:化学式的计算,溶液的组成及溶质质量分数的计算
分析:(1)依据相对分子质量等于各元素相对原子质量之和解决;根据元素的质量比=(C的相对原子质量×C的原子个数):(H的相对原子质量×H的原子个数):(O的相对原子质量×0的原子个数),计算即可;
(2)把20%的溶液配制成0.4%的溶液需要加水稀释,加水稀释前后溶液的溶质质量不变,据此可利用所需配制溶液计算出20%溶液的质量,再依据密度公式而求得.
(2)把20%的溶液配制成0.4%的溶液需要加水稀释,加水稀释前后溶液的溶质质量不变,据此可利用所需配制溶液计算出20%溶液的质量,再依据密度公式而求得.
解答:解:(1)相对原子质量等于各元素相对原子质量之和,故过氧乙酸的相对分子质量=12×2+1×4+16×3=76.
过氧乙酸中碳、氢、氧三种元素的质量比为C:H:O=(12×2):(1×4):(16×3)=6:1:12;
故填:76;6:1:12;
(2)15L=15000mL=15000cm3,设需要20%的过氧乙酸溶液的体积为x,则1.1g/cm3×x×20%=1.0g/cm3×15000cm3×0.4%
x≈272.7cm3=272.7mL.
答:需要20%的过氧乙酸溶液体积272.7mL.
故答案为:
15L=15000mL=15000cm3,设需要20%的过氧乙酸溶液的体积为x,则1.1g/cm3×x×20%=1.0g/cm3×15000cm3×0.4%
x≈272.7cm3=272.7mL.
答:需要20%的过氧乙酸溶液体积272.7mL.
过氧乙酸中碳、氢、氧三种元素的质量比为C:H:O=(12×2):(1×4):(16×3)=6:1:12;
故填:76;6:1:12;
(2)15L=15000mL=15000cm3,设需要20%的过氧乙酸溶液的体积为x,则1.1g/cm3×x×20%=1.0g/cm3×15000cm3×0.4%
x≈272.7cm3=272.7mL.
答:需要20%的过氧乙酸溶液体积272.7mL.
故答案为:
15L=15000mL=15000cm3,设需要20%的过氧乙酸溶液的体积为x,则1.1g/cm3×x×20%=1.0g/cm3×15000cm3×0.4%
x≈272.7cm3=272.7mL.
答:需要20%的过氧乙酸溶液体积272.7mL.
点评:化学式可以表示一种物质,反映物质的组成元素,据此可计算组成元素的质量比;化学式可以表示构成物质的一个分子,反映分子的构成,据此可计算相对分子质量.

练习册系列答案
相关题目
水是重要的自然资源,下列情况下,不会造成水污染是( )
| A、农药、化肥的任意使用 |
| B、工业废水的任意排放 |
| C、水生植物繁殖 |
| D、生活污水的任意排放 |
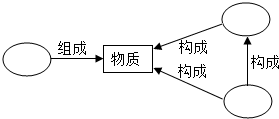 构建知识网络和进行知识归纳是学习化学的重要方法.
构建知识网络和进行知识归纳是学习化学的重要方法.