题目内容
化学实验是进行科学探究的重要方式,思考下列问题并回答。
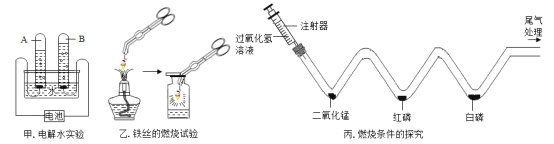
(1)实验甲中电源接通一段时间后,A管中产生气体为10 mL时,则B管中产生气体体积为___________mL,检验B管中生成的气体,可将__________伸入气体中。电解水时,向水中加入少量稀硫酸,目的是_____________。
(2)实验乙中,瓶底放少量水,目的是______________,若反应中没有看到“火星四射”的现象,可能的原因是______________(写一种即可)。
(3)实验丙中,将注射器中的溶液缓缓推入 V 形管,二氧化锰与过氧化氢溶液混合产生大量气泡,此处反应的化学方程式为_____________;用 80℃的热水加热盛有红磷和白磷的 W 形管时,发现白磷燃烧而红磷不燃烧,由此可说明燃烧需要的条件是___________ 。
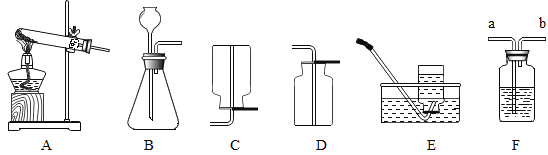
(4)某兴趣小组依据教材实验对质量守恒定律进行了如下探究,根据下图回答问题:
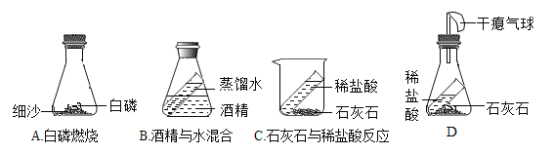
①如图 A、B、C三个实验装置(天平略),其中能用来验证质量守恒定律的是__________(填字母序号)。
②从微观角度解释反应前后质量守恒的原因是_________。
③小明将图 C 装置改进成如图 D 所示,装置气密性良好,但是反应后天平指针向右偏转,请解释原因___________。
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案研究小组设计下列实验方案探究CO2与NaOH溶液是否发生反应。
方案一:
[查阅资料]
①乙醇不与NaOH、Na2CO3、CO2反应;
②25℃时,NaOH和Na2CO3在乙醇中的溶解度如下表:
物质 | NaOH | Na2CO3 |
溶解度/g | 17.3 | <0.01 |
[实验装置] 如图1。
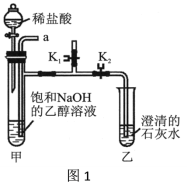
[实验步骤]
i.打开K1,关闭K2,从导管口a通入CO2气体,直至观察到饱和NaOH的乙醇溶液中产生大量沉淀,停止通CO2;
ii.从导管口a通入足量氮气;
iii.关闭K1,打开K2,向装置甲的试管中滴入足量的稀盐酸,观察装置乙的现象。
(1)步骤i产生沉淀的原因是___________________。
(2)步骤ii的目的是____________________。
(3)步骤iii装置乙中产生现象的原因是__________(用化学方程式表示)。
方案二:
[实验装置]
如图2(三颈瓶内集满CO2气体;装药品后的注射器B的活塞用夹子固定)。
[实验步骤]
按以下步骤完成实验,通过相对压强传感器测量瓶内压强的变化。整个实验过程的压强随时间变化如图3。
i.将注射器A内的NaOH溶液注入瓶中,测量压强直至不再改变;
ii.取下夹子,将注射器B内的盐酸注入瓶中,测量压强直至不再改变;
iii.将两个注射器的活塞都拉回原位,并都用夹子固定,测量压强直至不再改变。
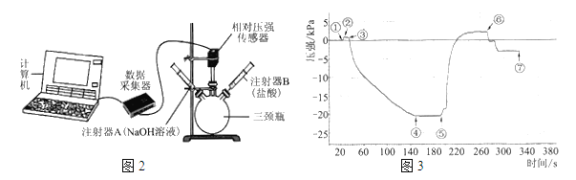
(4)检查图2装置气密性的方法:____________。
(5)为缩短①→④中反应的时间,可采取的操作是______________。
(6)写出导致⑤→⑥压强变化的主要反应的化学方程式:________。
(7)步骤iii结束后瓶内压强比注入NaOH溶液前小,其原因是__________。
(8)请结合图3信息,说明NaOH与CO2发生了反应。_________。


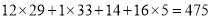

 B.
B.  C.
C.  D.
D. 