题目内容
【题目】氧气是我们身边无法离开的物质。某兴趣小组对氧气的研究如下:
Ⅰ.氧气的制备:
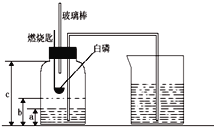
(1)写出右图中仪器①的名称:____;
(2)用高锰酸钾制取氧气的化学符号表达式____;用该装置作为发生装置时,试管口应放一团____。
(3)用氯酸钾和二氧化锰制备氧气时,某同学在实验室利用下列流程分离并回收充分反应后的剩余固体,回答下列问题(氯化钾可溶于水,二氧化锰难溶于水)。
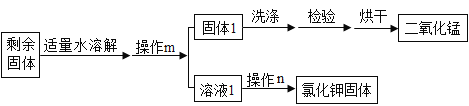
①操作m的名称是____,操作m和操作n中都用到的玻璃仪器是____,操作m中该仪器的作用是____。
②在分离并回收剩余固体的过程中需要控制水的用量,原因有____(填字母)。
a.保证剩余固体全部溶解 b.提高实验效率 c.节约酒精燃料
③若测得回收到的氯化钾固体质量比理论值小,原因可能是____(填字母)。
a.过滤时液面高于滤纸边缘 b.氯化钾没有完全溶解即过滤
c.器皿上粘有的氯化钾没有全部转移到称量纸上
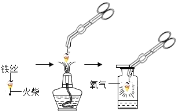
Ⅱ.铁丝在氧气中燃烧(如右图):
(4)铁丝在氧气中燃烧的化学符号表达式为____,生成物的颜色为____色。
(5)实验时铁丝末端系一根火柴的目的是____;集气瓶底部放少量水的目的是____。
【答案】酒精灯 KMnO4![]() K2MnO4 + MnO2 + O2, 棉花 过滤 玻璃棒 引流 bc bc Fe + O2
K2MnO4 + MnO2 + O2, 棉花 过滤 玻璃棒 引流 bc bc Fe + O2![]() Fe3O4 黑 引燃铁丝(提供热量) 防止溅落的熔化物炸裂瓶底
Fe3O4 黑 引燃铁丝(提供热量) 防止溅落的熔化物炸裂瓶底
【解析】
(1)仪器①的名称是酒精灯,故填酒精灯。
(2)高锰酸钾在加热的条件下反应生成锰酸钾、二氧化锰和氧气,故符号表达式写为:KMnO4![]() K2MnO4 + MnO2 + O2。
K2MnO4 + MnO2 + O2。
(3)用高锰酸钾制取氧气时,试管口应放一团棉花,防止高锰酸钾颗粒进入导管,故填棉花。
(4)分离难溶性固体与液体的方法是过滤,故填过滤。
(5)由图分析知。操作n为蒸发,过滤与蒸发都用到的仪器是玻璃棒,故填玻璃棒。
(6)过滤中玻璃棒的作用是引流,故填引流。
(7)控制水的用量可以缩短过滤的时间和加热的时间,提高实验的效率;加热时间短,也能节省酒精灯内的酒精,故选bc。
(8)a.过滤时液面高于滤纸边缘,浊液会流进滤液,得到的固体大于实际值,结果偏大,选项错误;b.氯化钾没有完全溶解即过滤,进入滤液中的氯化钾小于实际值,结果偏小,选项正确;c.器皿上粘有的氯化钾没有全部转移到称量纸上,称得数值小于实际值,求得结果偏小,故选bc。
(9)铁丝和氧气在点燃的条件下反应生成四氧化三铁,故符号表达式写为:Fe + O2![]() Fe3O4。
Fe3O4。
(10)四氧化三铁是黑色固体,固体黑色。
(11)实验时铁丝末端系一根火柴的目的是火柴燃烧后给铁丝提供热量,使铁丝的温度达到着火点燃烧,故填引燃铁丝(提供热量)。
(12)集气瓶底部放少量水的目的是防止生成的高温的熔化物溅落炸裂瓶底,故填防止溅落的熔化物炸裂瓶底。

【题目】小王进行H2O2溶液制O2的实验探究。结合下列过程,回答有关问题:
(1)MnO2(一种黑色难溶于水的粉末)作催化剂:向5mL5%的H2O2溶液中加入少量MnO2,产生大量气泡。该反应的文字表达式为___________________________,证明产生的气体是O2的方法是_____。
(2)FeC13溶液(一种黄色液体)作催化剂:向5mL5%的H2O2溶液中加入2滴一定浓度的 FeC13溶液,立即产生大量气泡。
(已知) FeCl3溶液中主要含有三种微粒:H2O、Fe3+、Cl—
(问题)哪种微粒对H2O2溶液的分解起催化作用?
(假设)假设一:可能是H2O 假设二:可能是Fe3+ 假设三:可能是Cl—
(分析)①小李认为假设一不可能成立,其理由是__________________________;
(实验)
步骤 | 操作 | 现象 |
1 | 其他条件不变,向H2O2溶液中加入NaCl溶液(含有H2O、Na+、Cl—) | 无明显变化 |
2 | 其他条件不变,向H2O2溶液中加入Na2SO4溶液(含有H2O、Na+、SO42—) | 无明显变化 |
3 | 其他条件不变,向H2O2溶液中加入Fe2(SO4)3溶液(含有H2O、Fe3+、SO42—) | 产生大量气泡 |
(结论)②假设__________成立,而假设一和另一种假设不成立。
(3)实验反思
①对于步骤3而言,步骤2主要是为了排除__________(填微粒符号)对实验的影响。
②催化剂比较:从便于回收再利用的角度分析,___________________更适合做该反应的催化剂。