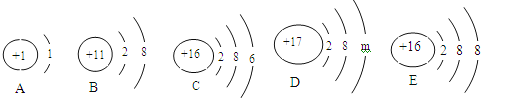
题目内容
【题目】将25克石灰石 (杂质不溶于水,也不与酸反应)放入烧杯中,恰好与100克稀盐酸完全反应,生成8.8克二氧化碳。试计算:(1)原样品中碳酸钙的质量分数;(2)原稀盐酸中溶质的质量分数。
【答案】(1) 80% (2)14.6%
【解析】
利用二氧化碳的质量,根据反应的化学方程式,分别计算恰好完全反应时碳酸钙的质量和HCl的质量,最后使用质量分数的计算公式,求出样品中碳酸钙的质量分数和所用盐酸的质量分数。
解:设石灰石中碳酸钙的质量为x 。盐酸中HCl的质量为y。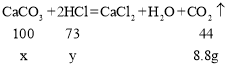
![]()
解得: x = 20g ,y=14.6g
则碳酸钙的质量分数=20 g /25 g×100% =80%
盐酸中的溶质质量分数为:14.6g/100g ×100% =14.6%。
答:(1)原样品中碳酸钙的质量分数为80%;(2)原稀盐酸中溶质的质量分数为14.6%。

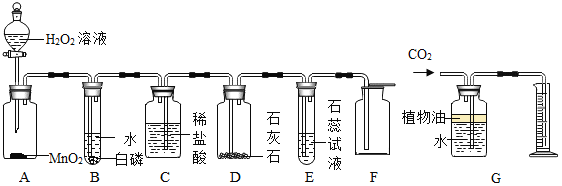
【题目】某校化学研究性学习小组探究气体制取的实验原理与方法.
(1)甲同学将课本的基础知识进行整理如上图,请你帮助他完成相关内容.
制取气体 | 所需要品 | 装置连接顺序 | 反应的化学方程式 |
二氧化碳(干燥) | 大理石和稀盐酸 | _________ | ________ |
(2)乙同学设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.当打开K1、关闭K2时,利用I、Ⅱ装置可直接进行的实验是_________(填序号).
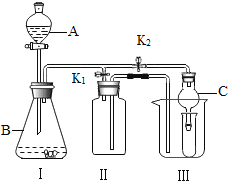
①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
(3)丁同学打开K2、关闭K1,利用I、Ⅲ装置来验证生成的二氧化碳中含有水蒸气,此时C中盛放的物质是_______________。
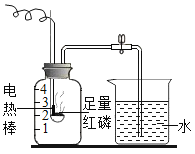
【题目】高锰酸钾在生产、生活中有广泛应用。实验小组的同学对高锰酸钾的某些性质和用途进行探究。
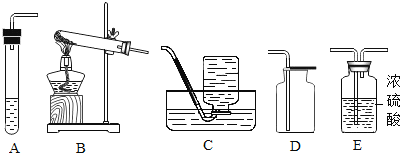
实验一、高锰酸钾制取氧气:如图,用下列给定的药品、用品:高锰酸钾、棉花、火柴及下列仪器,制取氧气.
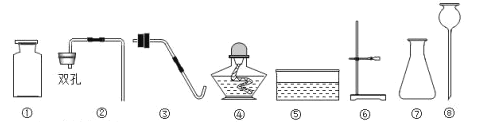
(1)仪器⑤的名称是_______________;
(2)制取并收集氧气时,应选用图中的仪器有_________。(填序号);利用此原理还需要补充的一种仪器是_________,在此实验中该仪器的用途是___________,该反应的方程式为:________________,根据所给仪器收集该气体应采用的收集方法是____。
(3)实验时需要使用酒精灯,下列使用酒精灯的操作正确的是__________(从图中选出正确的操作编号).

(4)小明用高锰酸钾制备氧气实验结束时,先熄灭酒精灯,导致水槽中的水倒流进人了导气管,可采用的补救措施是__________________(答一种即可)。
实验二、探究高锰酸钾的溶解性:小组同学设计了如图所示实验,请根据实验操作图示回答相关问题:
(1)步骤一:如图操作,振荡后静置,观察到:A试管中晶体全部溶解,溶液呈____色;B试管中晶体不溶解,汽油不变色;根据此实验可知影响物质溶解性的因素是__________。
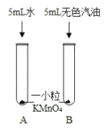
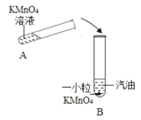
(2)步骤二:如图操作,将步骤一中A试管内溶液倒人B试管中,振荡后静置,观察现象。请你对B试管中出现的现象提出猜想并说明理由:________________________。
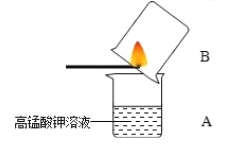
实验三、高锰酸钾溶液检验二氧化硫:如图所示,在小烧杯A中加入少量的稀高锰酸钾溶液。取一根小木条,在一头蘸一些硫粉,并点燃,迅速伸人烧杯B中,片刻后取出小木条,振荡烧杯A,可观察到烧杯A中出现的现象是 _____,该反应的化学方程式可表示为![]() ,其中X的化学式是_____,反应前后锰元素和硫元素化合价发生的变化分别是__________________。
,其中X的化学式是_____,反应前后锰元素和硫元素化合价发生的变化分别是__________________。
I拓展实验
实验过程中某同学的手上不小心沾上了高锰酸钾溶液,结果手上的皮肤变成了棕黄色,经过查阅资料结合已学过的化学知识分析原因,并在老师的指导下进行了如下拓展实验探究:
查阅资料:KMnO4溶液呈中性、有腐蚀性
讨论分析:构成皮肤细胞的基础物质是蛋白质,其属于_________(填“有机高分子化合物”或“碳水化合物”),遇到高锰酸钾溶液后被腐蚀,因此皮肤呈现棕黄色。进行如下两个实验探究KMnO4溶液对不同类物质的腐蚀性:
实验四、将新鲜鸡皮在不同浓度的KMnO4溶液中浸泡相同时间,现象如表:
KMnO4溶液浓度 | 0.002% | 0.01% | 0.1% | 1% |
鸡皮的变化 | 无明显变化 | 边缘部分变为棕黄色 | 全部变为棕色 | 全部变为黑色 |
实验五、将铜片分别浸泡在4种溶液中进行实验,浸泡相同时间,现象如下表:
编号 | ① | ② | ③ | ④ | |
实验 |
25mL0.1% KMnO4溶液 |
25mL0.1%KMnO4溶液+10滴浓硫酸 |
25mL蒸馏水+10滴浓硫酸 |
25mL1%KMnO4溶液+10滴浓硫酸 | |
铜片质量/g | 实验前 | 0.54 | 0.54 | 0.54 | 0.54 |
18小时后 | 0.54 | 0.52 | 0.54 | 0.43 | |
解释与结论:
(1)实验四的目的是_______________________________;
(2)实验五中通过对比②和④,得出的结论是______________________________;
(3)实验2中,欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,需要对比______(填编号)。
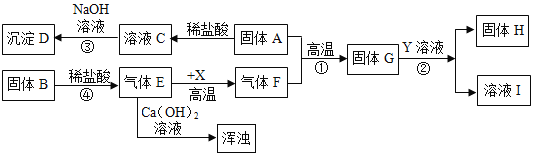
【题目】碱式碳酸镁高温能分解,可用于镁盐制备,制药工业等。其组成一般以xMgCO3·yMg(OH)2·zH2O表示。
Ⅰ.研究其分解产物
(1)取样高温灼烧,检测到有二氧化碳和水生成,充分反应后,得到白色固体,由此推断生成物中肯定不含金属镁及单质碳,理由是 。
(2)检验生成物中是否含有碳酸镁、氢氧化镁。
操作现象 | 结论 | |
① | 取适量生成物置于试管中, 。 | 生成物中不含碳酸镁。 |
② | 取适量生成物置于试管中,加入热水,滴入酚酞试液, 观察到 现象。 | 生成物中不含氢氧化镁。 |
;(3)用酚酞试液检验是否存在氢氧化镁不能用冷水代替热水是因为 。综合上述实验推断碱式碳酸镁的分解产物为二氧化碳、水和 。
Ⅱ.测定碱式碳酸镁中碳元素的质量分数
按下图一进行实验。
①量气管中装有饱和碳酸氢钠溶液,不能用水代替是因为 ,若用稀盐酸代替稀硫酸,则测出碳元素的质量分数将 (填“偏大”、“偏小”或“无影响”)。
②实验中共消耗稀硫酸20mL,根据所测数据求得生成气体的质量为1.32g,则进入量气管的气体体积为 ,碳元素的质量分数为 。(实验条件下CO2密度为1.97g/L)

Ⅲ.确定碱式碳酸镁的组成
设计如上图二装置,并按下述步骤操作。
步骤1:检查装置的气密性,将36.4g样品置于试管中,称量装置B的质量为192g。
步骤2:加热装置A直至样品完全反应。
步骤3:用止水夹夹紧装置A和装置B间胶皮管,停止加热,冷却至室温。
步骤4:称量装置B的质量为199.2g。
(1)装置B中物质为 ,装置C的作用为 。判断样品完全反应的方法:当观察到装置B中 ,则样品已完全反应。
(2)根据上述实验数据求出碱式碳酸镁的化学式,写出计算过程。 (3分)
Ⅵ.有人说“加热碱式碳酸镁最后阶段固体质量减少是因为生成二氧化碳”是真的吗?
另取一定量碱式碳酸镁样品在空气中加热,测出样品的固体残留率(![]() ×100%)随温度的变化如图所示,请回答下列问题。
×100%)随温度的变化如图所示,请回答下列问题。

①0至t1℃过程中固体质量保持不变的原因是 。
②分析图像数据判定该说法是 (填“真的”或“假的”),判定理由是 。