题目内容
国家规定,酿造食醋的总酸含量标准为3.5~5.0 g/100 mL(总酸含量即100 mL食醋中含醋酸的质量)。某兴趣小组为测定一市售食醋的总酸含量,进行了实验。实验后,得知10.0 mL该食醋样品与7.5 g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应。计算该市售食醋样品中的总酸含量,并说明是否符合国家标准。(食醋与氢氧化钠反应的化学方程式: CH3COOH+NaOH===CH3COONa+H2O,假设该市售食醋样品中 其他物质不与氢氧化钠发生反应)
其他物质不与氢氧化钠发生反应)
解:设10.0 mL 食醋样品中醋酸的质量为x。
CH3COOH+NaOH===CH3COONa+H2O
60 40
x 7.5 g×4%
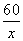 =
=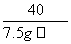
x=0.45 g
则100 mL食醋样品中醋酸的质量为:
0.45 g×100 mL÷10.0 mL=4.5 g
答:该市售食醋样品中的总酸含量符合国家标准。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目