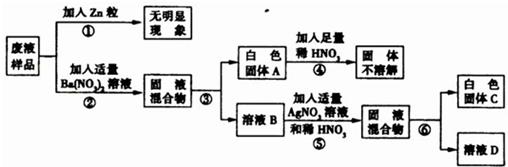
题目内容
(2010?沈阳)在做完盐的性质实验后,某实验小组欲对废液成分进行研究.根据实验所用药品,他们初步分析该废液中可能含有HCl、NaCl、Na2SO4、Na2CO3、KNO3中的几种.为确定废液成分,他们设计了如下过程进行实验.
请仔细分析实验过程,回答下列问题:
(1)步骤③、⑥的操作方法是______;
(2)白色固体A的化学式为______;
(3)步骤⑤中发生反应的化学方程式为______;
(4)废液中除了水以外,一定含有的物质是______,可能含有的物质是______.
(5)溶液D中一定含有的溶质是______.
【答案】分析:根据实验①废液不能与锌发生反应,可判断废液中不含HCl;根据实验①可知废液与硝酸钡反应生成了不溶于稀硝酸的硫酸钡沉淀,可判断废液中一定含有硫酸根离子,则废液中一定含有硫酸钠且一定不含碳酸钠;根据实验⑤向滤液B中加入硝酸银和稀硝酸产生白色沉淀C,则白色沉淀C为氯化银,滤液B中一定含有Cl-离子,可推断废液中一定含有氯化钠,可能含硝酸钾;废液中的硫酸钠、氯化钠先后与适量硝酸钡、硝酸银反应而形成硝酸钠,因此,溶液D为稀硝酸和硝酸钠的混合溶液.
解答:解:(1)步骤③、⑥的操作结果都是把不溶性固体与溶液分离,因此,该操作为过滤操作;
故答案为:过滤;
(2)不溶于稀硝酸的白色固体A为废液与硝酸钡反应的生成物,因此,固体A应为硫酸钡;
故答案为:BaSO4;
(3)步骤⑤,向溶液B中加入适量硝酸银和稀硝酸,产生不溶于稀硝酸的白色沉淀,该沉淀应为氯化银,溶液B中含有氯化钠,反应为NaCl+AgNO3=NaNO3+AgCl↓;
故答案为:NaCl+AgNO3=NaNO3+AgCl↓;
(4)根据实验流程图,可判断废液中一定含有能与硝酸钡、硝酸银形成不溶于稀硝酸的白色沉淀,即废液中一定含有硫酸钠和氯化钠;硝酸钾不能与其它物质发生复分解反应,因此,废液中含不含有硝酸钾对整个过程不产生影响,因此,废液中可能含有硝酸钾;
故答案为:硫酸钠、氯化钠(或Na2SO4、NaCl);硝酸钾(或KNO3);
(5)废液经过一系列变化后,其中的硫酸钠、氯化钠都被转化为硝酸钠,因此,最后所得溶液D为反应生成的硝酸钠及检验固体时所加入的稀硝酸的混合溶液;
故答案为:硝酸、硝酸钠(或HNO3、NaNO3).
点评:不溶于稀硝酸的白色沉淀只有硫酸钡和氯化银,这一特殊性是解决本推断题的关键.
解答:解:(1)步骤③、⑥的操作结果都是把不溶性固体与溶液分离,因此,该操作为过滤操作;
故答案为:过滤;
(2)不溶于稀硝酸的白色固体A为废液与硝酸钡反应的生成物,因此,固体A应为硫酸钡;
故答案为:BaSO4;
(3)步骤⑤,向溶液B中加入适量硝酸银和稀硝酸,产生不溶于稀硝酸的白色沉淀,该沉淀应为氯化银,溶液B中含有氯化钠,反应为NaCl+AgNO3=NaNO3+AgCl↓;
故答案为:NaCl+AgNO3=NaNO3+AgCl↓;
(4)根据实验流程图,可判断废液中一定含有能与硝酸钡、硝酸银形成不溶于稀硝酸的白色沉淀,即废液中一定含有硫酸钠和氯化钠;硝酸钾不能与其它物质发生复分解反应,因此,废液中含不含有硝酸钾对整个过程不产生影响,因此,废液中可能含有硝酸钾;
故答案为:硫酸钠、氯化钠(或Na2SO4、NaCl);硝酸钾(或KNO3);
(5)废液经过一系列变化后,其中的硫酸钠、氯化钠都被转化为硝酸钠,因此,最后所得溶液D为反应生成的硝酸钠及检验固体时所加入的稀硝酸的混合溶液;
故答案为:硝酸、硝酸钠(或HNO3、NaNO3).
点评:不溶于稀硝酸的白色沉淀只有硫酸钡和氯化银,这一特殊性是解决本推断题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(2010?沈阳)下表是氯化钠和硝酸钾在不同温度时的溶解度.
根据表中数据,回答下列问题:
(1)找出氯化钠与硝酸钾溶解度相等时所对应的温度范围______;
(2)20℃时,将18g氯化钠溶于75g水中得到氯化钠溶液,现欲改配成该温度下的饱和溶液,需再加入______g氯化钠固体;
(3)提纯混有少量氯化钠的硝酸钾固体,最好的方法是______.
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | ||
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 45.8 | 85.5 | 110 | 138 | |
(1)找出氯化钠与硝酸钾溶解度相等时所对应的温度范围______;
(2)20℃时,将18g氯化钠溶于75g水中得到氯化钠溶液,现欲改配成该温度下的饱和溶液,需再加入______g氯化钠固体;
(3)提纯混有少量氯化钠的硝酸钾固体,最好的方法是______.