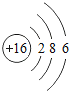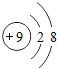题目内容
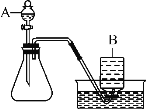
【题目】过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解生成氧气和水,分液漏斗可以通过调节活塞控制液体的滴加速度。
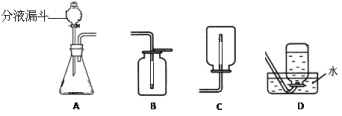
回答下列问题:
(1)分液漏斗中应放入的物质是_____,锥形瓶中应放入的物质是________。
(2)写出该方法制取氧气的文字表达式_______;要收集一瓶较纯净的氧气,应选择装置____(填字母)。
(3)某同学在观察到锥形瓶内有大量气泡时,开始用B装置收集氧气,过一段时间后,用带火星的木条伸到瓶口,看到木条__________,表明已收集满。
(4)若实验时用此法代替高锰酸钾加热制取氧气,优点是________(填编号)。
①生成物只有氧气②不需加热③需加热
(5)装置A中反应很剧烈,据此提出实验安全注意事项是______(填编号)。
①控制液体的滴加速度②用体积较小的锥形瓶③加热反应物
【答案】过氧化氢溶液;二氧化锰过氧化氢![]() 水+氧气D复燃②①
水+氧气D复燃②①
【解析】
(1)图中分液漏斗是加入过氧化氢溶液的仪器;该实验中应该先将二氧化锰装入锥形瓶中,后经分液漏斗加入过氧化氢;
(2)过氧化氢在二氧化锰作催化剂的条件下反应生成水和氧气,反应的文字表达式为:过氧化氢![]() 水+氧气;用排水法收集的气体较纯,故选D。
水+氧气;用排水法收集的气体较纯,故选D。
(3)氧气收集满后会向瓶口外溢,故遇到带火星的木条,木条会复燃,证明已经收集满。
(4)用过氧化氢制取氧气不需要加热,生成物只有水和氧气,故选②。
(5)装置A中反应很剧烈,需要控制反应的速率。①控制液体的滴加速度可以控制反应的速率,制取;②用体积较小的锥形瓶不能控制反应速率,故错误;③加热反应物会加快反应的速率,故错误。故选①。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案【题目】某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)。
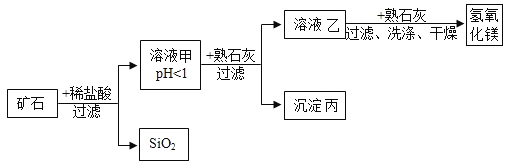
请回答下列问题:
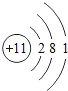
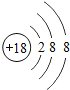
⑴溶液A中共含有_______种阳离子;写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式_____________(只写一个).
⑵在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子逐步转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,所得溶液B的pH的取值范围为_______________。
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 8.6 |
完全沉淀的pH | 3.2 | 6.7 | 11.1 |
⑶写出溶液B中加入熟石灰发生的化学反应方程式_______________。