题目内容
【题目】碳酸钙是工业生产的重要原料,现在一烧杯中盛有CaCO3和CaCl2的粉末状混合物42.2g,向其中加入168.8g水,使混合物中的可溶物完全溶解。然后再向其中逐渐加入溶质的质量分数为10%的稀盐酸,烧杯中溶液的质量与所加入稀盐酸的质量关系曲线如下图所示。请根据题意回答下列问题:
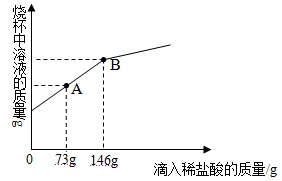
(1)写出在整个实验过程中观察到的一项实验现象: 。
(2)当滴入10%的稀盐酸至图中A点时,烧杯中溶液里含有的溶质是(写化学式)_______________。
(3)在CaCO3和CaCl2的混合物样品中,含CaCO3的质量为____________ ___g。
(4)当滴入10%的稀盐酸146g时(即B点),试通过计算,求此时烧杯中所得不饱和溶液的质量。(计算结果精确到0.1g)
【答案】(1)有气泡冒出;(2)CaCl2;(3)20g(4)348.2g
【解析】
试题分析
(1)因为盐酸能与碳酸钙反应生成气体,故能看到有气泡冒出;
(2)当滴入10%的稀盐酸至图中A点时,烧杯中溶液里含有的溶质是CaCl2;
(3)B点时碳酸钙反应完全,故根据盐酸的质量可计算出碳酸钙的质量为20g
(4)解:146g质量分数为10%的稀盐酸中含有的氯化氢的质量为:
设消耗碳酸钙的质量为x,生成二氧化碳的质量为x
CaCO3+ 2HCl=CaCl2+ H2O +CO2↑
100 73 44
x 14.6g y
100/x=73/14.6g 44/y=73/14.6g
x=20g y=8.8g(1分)
反应后所得溶液的质量是:42.2g +168.8g+146g-8.8g=348.2g(2分)
答:反应后所得溶液的质量是348.2g。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】比较、推理是化学学习常用的方法,以下是根据一些反应事实推导出的影响化学反应的因素,其中推理不合理的是
化 学 反 应 事 实 | 影响化学反应的因素 | |
A | 纸在空气中常温下不会燃烧,而点燃后可以燃烧 | 反应温度 |
B | 加热氯酸钾反应速率较慢,加入二氧化锰后速度变快 | 催化剂 |
C | 大块木头不易点燃,而刨成刨花却易点燃 | 反应物种类 |
D | 木炭在氧气中燃烧比在空气中更剧烈 | 反应物浓度 |