题目内容
【题目】(5分)KNO3和NaCl在不同温度时的溶解度如下表所示。请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | |
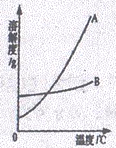
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图所示:
图中能表示KNO3溶解度曲线的是 (填“A”或“B”)
(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解度,则温度的范围是 。
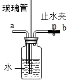
(3)某兴趣小组做了一下实验:
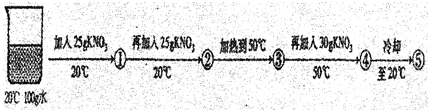
上述实验过程中得到的溶液一定属于不饱和溶液的是 (填数字序号),将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体 g;/span>
(4)硝酸钾中含有少量氯化钠时,可通过 (填“蒸发结晶”或“降温结晶”)的方法提纯。
【答案】(1)A(2)20℃至30℃时
(3)①③④ 59.1g
(4)降温结晶
【解析】
试题分析:(1)根据表中数据可知:在0℃时硝酸钾的溶解度小于氯化钠的溶解度;而根据图像可知:在0℃时A的溶解度小于B的溶解度;所以A表示硝酸钾的溶解度曲线。
(2)根据表中数据可知:在20℃时硝酸钾的溶解度小于氯化钠的溶解度;在30℃时硝酸钾的溶解度大于氯化钠的溶解度;所以二者在温度为20℃至30℃时溶解度相等。
(3)在20℃时硝酸钾的溶解度为31.6g。即在20℃温度下,硝酸钾在100g水里达到饱和状态时所溶解的质量为31.6g。因此题目中向100g水里25g硝酸钾时,所得溶液①为不饱和溶液;向溶液①再加25g硝酸钾时,硝酸钾的总质量为50g;而20℃时硝酸钾最多溶解31.6g,此时溶液②为饱和溶液。溶液②加热至50℃时,此时硝酸钾的溶解度为85.5g。此时硝酸钾的总质量为50g,所以溶液③为不饱和溶液。再加入30g硝酸钾,硝酸钾的总质量为80g,所以溶液④仍为不饱和溶液。溶液④冷却至20℃,得到的溶液⑤中硝酸钾的总质量为80g,硝酸钾的溶解度为31.6g。此时溶液为饱和溶液。所以溶液①③④为不饱和溶液。 将溶液⑤继续冷却至10℃,硝酸钾的溶解度为20.9g,此时硝酸钾的总质量为80g。所以析出固体的质量为:80g—20.9g=59.1g
(4)当温度变化时,硝酸钾的溶解度变化较大,而氯化钠的溶解度变化较小。所以可通过降温结晶的方法提纯硝酸钾。

【题目】(6分)初中常见的3种元素X、Y和Z的相关信息如下表所示。
元素 | X | Y | Z |
相关 信息 | 其单质甲是 一种清洁能源 | 地壳中含量 最多的元素 | 其一种单质是天然 存在的最硬的物质 |
(1)甲的化学式是 。
(2)ZY2可与Z的单质在高温条件下反应生成ZY,该反应的化学方程式是 。
(3)下列关于X2Y 和 X3Y+ 两种粒子的叙述中,不正确的是 (填序号)。
a.质子总数相同 b.电子总数相同
c.化学性质相同 d.相对分子质量相同
(4)A、B、C是由上述3种元素组成的单质或化合物,G由Ca、Y和Z 3种元素组成。它们之间的转化关系如下图所示。(“→”表示转化关系,部分反应物、生成物及反应条件已略去)
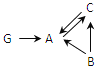
①G的化学式是 。
②若A中不含X元素,则C→A的化学方程式是 。
③若A中不含Z元素,则B→C的化学方程式是 。