题目内容
【题目】某化学兴趣小组对酸、碱、盐的部分性质进行探究。
 [Failed to download image : blob:http://qbm.xkw.com/5cbf80c2-c013-4758-829e-af2065b16abd]
[Failed to download image : blob:http://qbm.xkw.com/5cbf80c2-c013-4758-829e-af2065b16abd]
(探究一)氢氧化钠与二氧化碳反应。甲同学设计如图一所示实验:
(1)实验现象为_____,甲由此判断氢氧化钠和二氧化碳发生了反应。有同学认为甲方案不完善,理由是_____,为使实验更加严谨,你认为应该补做的实验是_____。
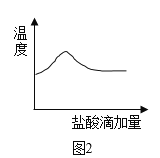
(探究二)氢氧化钠和盐酸反应时放热。乙同学向一定量10%的氢氧化钠溶液中滴加10%的盐酸,滴加过程中温度变化如图二所示。
(2)反应的化学方程式为_____,根据图二分析混合溶液温度变化的原因___。
小组内其他同学提出“将10%的盐酸直接滴入氢氧化钠固体中也能得出相同结论”,你认为_____(选填“合理”或“不合理”),请说明理由____。
(探究三)丙将甲和乙实验后的溶液混合,未发现明显现象。
(3)现将混合液中的氯化钠提纯析出,具体操作为_____。
(查阅资料)碳酸钠溶液中滴加稀盐酸分步反应,第一步生成碳酸氢钠和氯化钠。
丁同学向106g 10%的碳酸钠溶液中逐滴加入3.65%的稀盐酸,生成二氧化碳的质量变化如图三所示(不考虑CO2的溶解)。
(4)请写出A→C段发生反应的化学方程式_____,若B点对应横坐标为150,则其纵坐标为____。
【答案】塑料瓶变瘪(或扁) 氢氧化钠溶液中有水,二氧化碳能溶于水并能与水反应 将氢氧化钠溶液换成等体积的水,与加入氢氧化钠溶液的实验现象进行对比。(或向产物中加入稀盐酸,如产生大量气泡,则说明二氧化碳和氢氧化钠发生反应。合理即可) NaOH + HCl = NaCl + H2O 盐酸与氢氧化钠溶液反应放热,使滴加过程中温度升高,反应结束盐酸过量,盐酸冷却混合液(或散热)使温度下降。(合理即可) 不合理 氢氧化钠固体溶解也会放热 向溶液中滴加过量(或适量)盐酸至不再产生气泡后蒸发结晶 NaHCO3 + HCl = NaCl + CO2↑ + H2O 2.2
【解析】
(1)二氧化碳与氢氧化钠反应后,内部气体减少,压强降低,外界大气压将瓶子压瘪;由于氢氧化钠溶液中有水,二氧化碳能溶于水,且与水反应生成碳酸,也能使二氧化碳减小,造成压强变化,因此为了排除此影响,所以需要进行对比试验,加入等体积的水,观察与加入氢氧化钠溶液的现象,进行对比,验证实验结论;
(2)氢氧化钠与盐酸反应生成氯化钠和水,化学方程式NaOH + HCl = NaCl + H2O;酸碱中和反应为放热反应,会使反应温度升高,反应结束后,不再放热,温度开始降低,加入盐酸后,溶液体积变大,使得温度下降更快,当加入盐酸至一定量,没有热量变化,温度趋于平稳;氢氧化钠固体溶解时,会放出热量,温度升高较大,与上述温度变化不同,因此不能直接将稀盐酸滴入到固体氢氧化钠中;
(3)结合题意,乙中溶液的溶质是稀盐酸和氯化钠;混合后没有明显现象,说明甲中存在的溶液溶质为碳酸钠和氢氧化钠,两者混合后,稀盐酸和氢氧化钠反应生成氯化钠和水,因为混合后没有明显现象,说明稀盐酸已经反应完,不能和碳酸钠继续反应,因此混合后溶液溶质一定有氯化钠和碳酸钠,可能有氢氧化钠,为了得到氯化钠,则可以加入足量的盐酸,将碳酸钠、氢氧化钠全部转化为氯化钠,通过蒸发结晶得到氯化钠晶体,过量的盐酸被加热挥发;
(4)根据题目信息,碳酸钠先与盐酸反应生成碳酸氢钠,此时没有气体生成,而A点之后有气体生成,说明是碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,化学方程式NaHCO3+ HCl = NaCl + CO2↑ + H2O;设碳酸钠第一步消耗盐酸的量为![]() ,碳酸钠质量=106g×10%=10.6g,B点时消耗盐酸的质量=150g×3.65%=5.475g,
,碳酸钠质量=106g×10%=10.6g,B点时消耗盐酸的质量=150g×3.65%=5.475g,
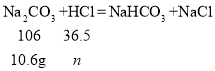
![]()
![]() =3.65g
=3.65g
所以在A到B之间消耗盐酸质量=5.475g-3.65g=1.825g,设生成二氧化碳的质量为![]() ,
,
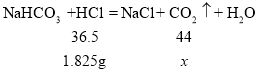
![]()
![]() =2.2g
=2.2g
所以B点对应的纵坐标为2.2。

 阅读快车系列答案
阅读快车系列答案