题目内容
【题目】为测定某赤铁矿石中氧化铁的质量分数,小龙和他的同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图.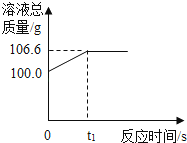
(1)上述反应产生二氧化碳的质量为g;
(2)计算该赤铁矿石中氧化铁的质量分数.
【答案】
(1)6.6
(2)
设赤铁矿石中氧化铁的质量为x,
3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
160 3×44
x 6.6g
![]()
解得x=8g
样品中氧化铁的质量分数为:![]()
![]() ×100%=80%
×100%=80%
答:该样品中氧化铁的质量分数为80%。
【解析】解:(1)二氧化碳能与氢氧化钠反应生成碳酸钠和水,故溶液的增重值即为二氧化碳的质量,由图象知,反应产生二氧化碳的质量为106.6﹣100.0=6.6g;
(2)设赤铁矿石中氧化铁的质量为x,
3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
160 3×44
x 6.6g![]()
解得x=8g
样品中氧化铁的质量分数为:![]()
![]() ×100%=80%
×100%=80%
答:该样品中氧化铁的质量分数为80%。
故答案为:(1)6.6;(2)答:该样品中氧化铁的质量分数为80%
(1)利用反应前后氢氧化钠的增重即为二氧化碳的质量,结合分析图象可得二氧化碳的质量;(2)根据二氧化碳的已知量,设出未知量三氧化二铁,利用化学方程式3CO+Fe2O3![]() 2Fe+3CO2 , 列比例式,即可求出三氧化二铁的质量,然后根据氧化铁的质量分数;分析图表中数据时,要关注造成数据发生变化的原因,分析数据不再改变时所说明的问题,从而发现隐含条件.
2Fe+3CO2 , 列比例式,即可求出三氧化二铁的质量,然后根据氧化铁的质量分数;分析图表中数据时,要关注造成数据发生变化的原因,分析数据不再改变时所说明的问题,从而发现隐含条件.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目