题目内容
【题目】 向100g稀H2SO4溶液中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀质量与加入NaOH溶液质量关系如图所示。请回答:
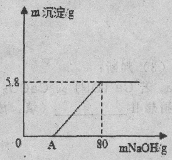
(1)OA段无沉淀产生,请写出反应的化学方程式
(2)加入镁粉的质量为 g;
(3)求产生氢气的质量是多少g?(写出计算过程,保留小数点后一位)。
【答案】 (1)2NaOH+H2SO4==Na2SO4+2H2O、(2)2.4g (3) 0.2g
【解析】
试题分析:由题中的叙述可知:(1)OA段无沉淀产生,说明溶液中含有未反应的硫酸,故反应的化学方程式为:2NaOH+H2SO4==Na2SO4+2H2O;(2)根据质量守恒定律反应前后元素守恒,故沉淀氢氧化镁中镁元素的质量就是加入的镁粉的质量,故5.8g×![]() 2.4g;(3)设生成氢气的质量为X
2.4g;(3)设生成氢气的质量为X
Mg + H2SO4 === MgSO4 + H2↑
2
2.4g X
24:2=2.4g:X
X=0.2g
答:加入镁粉的质量为2.4g,生成氢气的质量为0.2g

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目

