题目内容
【题目】20℃时,NaCl的溶解度为36.0g,现有该温度下200g 5%的NaCl溶液,求下列变化后溶液中NaCl的质量分数。
(1)加10gNaCl完全溶解:_______;
(2)加20g水:_______;
(3)蒸发20g水:_______。(计算结果精确到0.1%)
【答案】9.5% 4.5% 5.6%
【解析】
溶液稀释前后,溶质质量不变。
(1)加10gNaCl完全溶解,溶液中NaCl的质量分数为![]()
(2)加20g水,溶液中NaCl的质量分数为![]()
(3)20℃时,NaCl的溶解度为36.0g,溶质质量分数为![]() ,发20g水,溶液中NaCl的质量分数为
,发20g水,溶液中NaCl的质量分数为![]() ,则蒸发20g水后溶液中不析出溶质,故溶液中NaCl的质量分数为5.6%。
,则蒸发20g水后溶液中不析出溶质,故溶液中NaCl的质量分数为5.6%。

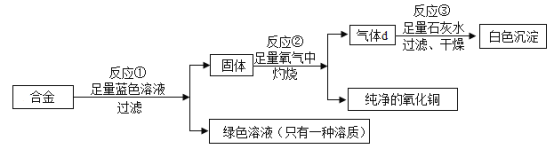
【题目】在学习实验室制取二氧化碳选用试剂研究中,一般都会以块状大理石和稀盐酸、粉末状大理石与稀盐酸、碳酸钠与稀盐酸、块状大理石与稀硫酸进行对比实验探究。化 学兴趣小组就除反应物状态以外影响大理石与稀盐酸反应快慢因素进行了如下探究。
(提出问题)大理石与稀盐酸反应的快慢还会受哪些因素的影响?
(猜想假设)
假设一:可能与温度的高低有关。 假设二:可能与稀盐酸的浓度有关。
(设计并实验)小组成员用不同质量分数的稀盐酸和不同环境温度下进行如下实验:
实验 序号 | 盐酸的质量分数 (均取 20mL) | 大理石 的质量 | 实验环 境温度 | 收集相同体积的二氧 化碳所用时间(秒) |
1 | 10% | 2g | 20℃ | 59.8 |
2 | 10% | 2g | 35℃ | 41.7 |
3 | 20% | 2g | 20℃ | 35.5 |
4 | 20% | 2g | 35℃ | 27.2 |
(1) 写出实验室制取二氧化碳的反应化学方程式_____。
(收集证据)
(2) 要比较不同温度对反应快慢的影响应选择实验编号是_____;要比较不同质量分 数的稀盐酸对反应快慢的影响应选择实验编号是_____。
(总结反思)
(3)小组经过讨论分析得出如下结论:
a、温度与大理石与稀盐酸反应快慢的关系:_____;
b、稀盐酸浓度与大理石与稀盐酸反应快慢的关系:___________________。
(4)本实验除用收集相同体积气体所需要的时间这一产生产物的快慢来定量比较反应速率快慢外,还可以采用其他什么方法来比较反应速率的快慢(除观察产生气泡的快慢)? 答:_____。
【题目】兴趣小组的同学在社会实践基地发现一袋商标模糊的硝酸铵化肥。同学们要帮助基地的工作人员测定化肥中硝酸铵的含量,请你参与他们的探究活动。
(查阅资料)①铵态氮肥易溶于水。②铵态氮肥与碱反应产生氨气。③氨气易溶于水,溶液呈碱性。
(实验过程)小丽同学准确称取9.0 g硝酸铵化肥样品,与过量的氢氧化钙粉末混合,充分反应后,产生的氨气用足量的稀硫酸全部吸收,测得2分钟内稀硫酸溶液质量的变化,记录如下表所示(样品中的杂质不含氮元素,也不与氢氧化钙反应)。
时间/s | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
溶液增加的质量/g | 0 | 0.7 | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
(数据处理)
计算此化肥中硝酸铵的质量分数_____(写出计算过程)。
(反思交流)
化肥对粮食增产有着重要的作用,如何科学合理使用或贮存铵态氮肥,请你给工作人员提一条合理化建议_____。