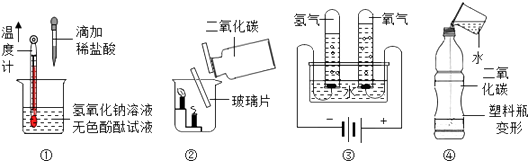
题目内容
【题目】黄铜(铜锌合金)是重要的金属材料.为测定黄铜材料中锌的含量,化学研究小组进行了实验: 称取15.0g 此黄铜材料,向其中逐渐加入稀盐酸,测定产生气体的质量和加入稀盐酸的质量,并根据实验情况绘制了产生气体质量与加入稀盐酸的关系图.请你仔细分析此关系图,并进行计算:
(1)15.0g黄铜材料中含锌g.
(2)稀盐酸中溶质的质量分数(写出计算过程,计算结果精确到0.1%) 
【答案】
(1)6.5
(2)解:设参加反应的锌的质量为x,参加反应的纯净的盐酸为y,
Zn+ | 2HCl=ZnCl2+ | H2↑ |
65 | 73 | 2 |
X | Y | 0.2g |
![]() =
= ![]() =
= ![]()
x=6.5g
y=7.3g
所以稀盐酸中溶质的质量分数为: ![]() ×100%=18.3%
×100%=18.3%
【解析】解:设参加反应的锌的质量为x,参加反应的纯净的盐酸为y,
Zn+ | 2HCl=ZnCl2+ | H2↑ |
65 | 73 | 2 |
X | Y | 0.2g |
![]() =
= ![]() =
= ![]()
x=6.5g
y=7.3g
所以稀盐酸中溶质的质量分数为: ![]() ×100%=18.3%.
×100%=18.3%.
所以答案是:(1)6.5;(2)18.3%.
【考点精析】解答此题的关键在于理解根据化学反应方程式的计算的相关知识,掌握各物质间质量比=系数×相对分子质量之比.

 考前必练系列答案
考前必练系列答案【题目】已知氯化钠、碳酸钠在不同温度时的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35 | 35.5 | 36 | 36.5 | 37 |
碳酸钠 | 6 | 10 | 18 | 36.5 | 50 | |
(1)依据上表数据,绘制出了氯化钠和碳酸钠的溶解度曲线(如图,图中能表示碳酸钠溶解度曲线的是(填“A”或“B”).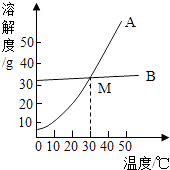
(2)图中两溶解度曲线相交于M点,此点表示的意义是 .
(3)40℃时,把50gA物质放入100g水中,充分搅拌,所得溶液是溶液(填“饱和”或“不饱和”).
(4)生活在盐湖(主要成分是NaCl和Na2CO3)附近的人们习惯“夏天晒盐(NaCl),冬天捞碱(Na2CO3)”.请你答出“冬天捞碱”的道理 .
【题目】某小组同学进行了有关蜡烛成分测定的实验,请你帮他们完成实验报告:
实验步骤 | 现象 | 结论 | |
| 在蜡烛火焰上方罩一个冷而干燥的烧杯 | 烧杯内壁有小液滴 | 产物中有 |
将内壁涂有的烧杯罩在火焰上方 | 产物中有二氧化碳 | ||
由此可知:蜡烛的成分中一定含有 , 可能还含有元素.