题目内容
【题目】(13分)在各种金属材料中铜是人类应用比较广泛的金属之一,某学习小组欲测定铜的相对原子质量,设计如下实验方案:
实验步骤:①连接好装置,② ③装入药品 ④打开分液漏斗活塞向锥形瓶中滴加入稀盐酸 ⑤一段时间后点燃酒精灯⑥D中黑色固体完全变成红色,停止加热,待D中玻璃管冷却至室温,关闭分液漏斗活塞 ⑦数据处理

请回答下列问题:
(1)补全实验步骤② 。
(2)若使制取氢气是装置随开随用,随关随停,下列装置可选用的是 。
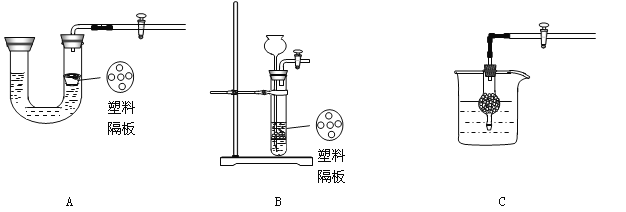
(3)B装置中水的作用 ,长玻璃管的作用 ,C装置的作用
(4)已知:CuO样品质量为m1克,E中增重为m2克,D中反应后固体质量为m3克,实际参加反应氢气的质量为m4克,试用m1,m2列出铜的相对原子质量的表达式 。若无F装置,则对测定结果的影响 (填“偏大”、“偏小”、“无影响”),以下数据还能测定铜的相对原子质量的是 。
A.m2 m3 B.m3 m4 C.m1 m4 D.m2 m4
(5)请你评价实验有什么不妥之处,并说明原因 。
【答案】(1)检验装置的气密性;(2)AB;
(3)吸收会发出的氯化氢气体;保持内外压强相等;干燥气体;
(4)2(9m1-8m2)/m2 ;偏小;D
(5)制取氢气不应该选用稀盐酸,,因为盐酸有挥发性,在除去氯化氢的同时,增加了装置的复杂性;
【解析】
试题分析:根据实验室气体的制取和净化的方式和步骤可知,(1)步骤②为检验装置的气密性;(2)使制取氢气是装置随开随用,随关随停,下列装置可选用的是AB,二者都能达到固液分离;(3)B装置中水的作用吸收会发出的氯化氢气体;长玻璃管的作用保持内外压强相等;C装置的作用干燥气体;(4)已知:CuO样品质量为m1克,E中增重为m2克,D中反应后固体质量为m3克,实际参加反应氢气的质量为m4克,根据化学反应方程式可知设:铜的相对原子质量为X
H2 + CuO △ Cu + H2O;
X+16 18
m1 m2
得X=2(9m1-8m2)/m2 若无F装置,则对测定结果的影响偏小,因为生成的水的质量偏大;以下数据还能测定铜的相对原子质量的是D m2 m4(5)制取氢气不应该选用稀盐酸,,因为盐酸有挥发性,在除去氯化氢的同时,增加了装置的复杂性;

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】(9分)操作和保存药品不当,标签常常易损毁。现有四瓶溶液①②③④的试剂标签已破损(如下图),但是已经知道这四瓶试剂是NaOH、Ca(OH)2、Na2CO3、KCl溶液中的一种,某兴趣小组同学决定对四瓶破损标签溶液成分进行实验探究(实验另外药品只提供盐酸和酚酞溶液):
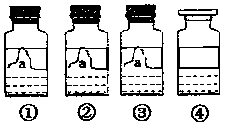
【提出问题】标签已经破损的①②③④四瓶溶液分别是什么溶液?
【实验探究1】第④瓶试剂肯定是: (写化学式)。
【实验探究2】兴趣小组对①②③④瓶溶液进行了如下的实验探究:
序号 | 实验步骤 | 实验现象 | 实验结论 |
1 | 取①②③瓶溶液少量 于三支试管中,分别 加入酚酞试液 | 酚酞试液不能将其中 的一种溶液鉴别出来 | |
2 | 再取①②③瓶溶液少 量于另外三支试管中 分别加入 溶液 | 加入了①溶液的试管 中 ; 其余两支试管中无明显现象 | ①瓶溶液为Na2CO3 |
3 | 取②③瓶溶液少量于 两支试管中,分别加 入 溶液 | 加入了②溶液的试管 中 ; 加入了③溶液的试管 中 ; | ②瓶溶液为 ③瓶溶液为 Ca(OH)2 |
【反思与交流】为了防止标签发生破损,我们在倾倒溶液时应注意: 。