题目内容
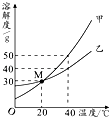
【题目】甲、乙、丙三种物质的溶解度曲线如右图所示.据图回答: 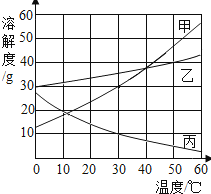
(1)50℃时,乙物质的溶解度是g;
(2)30℃时,三种物质的溶解度由大到小的顺序为;
(3)要使接近饱和的丙物质溶液变为饱和,可采取的一种措施是;
(4)50℃时,将等质量的甲.乙.丙三种物质的饱和溶液同时降温至10℃时,析出晶体最多的是 , 所得溶液中溶质质量分数最小的是.
【答案】
(1)40
(2)乙>甲>丙
(3)升高温度或蒸发溶剂
(4)甲;乙
【解析】解答:(1)从50℃向上作垂线与乙物质曲线的交点,再向纵坐标作垂线,所得的数值就是该温度下的溶解度,是40g;(2)30℃时,三种物质的溶解度由大到小的顺序为:乙>甲>丙;(3)由不饱和变为饱和有:增加溶质.蒸发溶剂,由于丙物质的溶解度随温度的升高而减小,所以升高温度会变为饱和溶液,增加溶质或蒸发溶剂溶液的质量都改变,所以在不改变溶液质量的情况下,要使接近饱和的丙物质溶液变为饱和,可采取的一种措施是升高温度或蒸发溶剂;(4)等质量的饱和溶液降低相同的温度,溶解度变化大的析出晶体多,由图示可知降温后甲物质析出晶体最多;据饱和时质量分数的计算式: ![]() ×100%,即溶解度越大质量分数也就越大;降温至10℃时乙的溶解度大于甲的,所以降温后乙的溶液溶质质量分数大于甲,因为丙溶液降温后溶解度变大,溶质质量分数没变,由于10℃时甲的溶解度大于50℃时丙的溶解度,所以溶质质量分数最大的是乙溶液. 分析:(1)根据溶解度曲线可知某温度下物质的溶解度;(2)据溶解度曲线可比较同一温度下不同物质的溶解度大小;(3)根据不饱和溶液变为饱和溶液的方法并结合题意分析解答;(4)等质量的饱和溶液降低相同的温度,溶解度变化大的析出晶体多,并结合物质的溶解度随温度变化情况及溶质的质量分数计算分析解答.
×100%,即溶解度越大质量分数也就越大;降温至10℃时乙的溶解度大于甲的,所以降温后乙的溶液溶质质量分数大于甲,因为丙溶液降温后溶解度变大,溶质质量分数没变,由于10℃时甲的溶解度大于50℃时丙的溶解度,所以溶质质量分数最大的是乙溶液. 分析:(1)根据溶解度曲线可知某温度下物质的溶解度;(2)据溶解度曲线可比较同一温度下不同物质的溶解度大小;(3)根据不饱和溶液变为饱和溶液的方法并结合题意分析解答;(4)等质量的饱和溶液降低相同的温度,溶解度变化大的析出晶体多,并结合物质的溶解度随温度变化情况及溶质的质量分数计算分析解答.
【考点精析】通过灵活运用固体溶解度曲线及其作用和溶质的质量分数,掌握1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和);溶质的质量分数=(溶质质量/溶液质量)*100% = [溶质质量/(溶质质量+溶剂质量]*100%即可以解答此题.

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案