题目内容
【题目】金属材料广泛应用于生产生活中。
(1)由于铜具有良好的______性,所以铜常用于制作导线。
(2)铝在空气中表现出良好的抗腐蚀性能,用化学方程式表示其原因______。
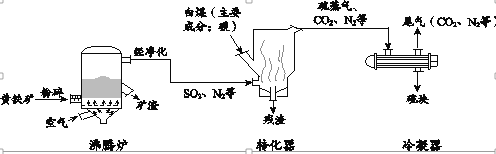
(3)用化学方程式表示以赤铁矿石(主要成分为![]() )为原料冶炼生铁的反应原理:_____。
)为原料冶炼生铁的反应原理:_____。
(4)向![]() 、
、![]() 、
、![]() 的混合溶液中,加入一定量的铁粉,充分反应后过滤,滤液呈蓝色。下列判断正确的是_____(填序号)。
的混合溶液中,加入一定量的铁粉,充分反应后过滤,滤液呈蓝色。下列判断正确的是_____(填序号)。
A 向滤渣中加入稀盐酸,可能有气泡产生
B 滤液中一定含有![]() 、
、![]() 和
和![]()
C 与原溶液相比,滤液的质量可能增大
D 向滤液中滴入稀盐酸,可能会有白色沉淀出现
(5)现有碳酸氢钠样品![]() (杂质不含钠元素,受热不变化),其中钠元素的质量分数为23%,180℃时,将样品加热一段时间后称得固体质量为
(杂质不含钠元素,受热不变化),其中钠元素的质量分数为23%,180℃时,将样品加热一段时间后称得固体质量为![]() ,则分解的碳酸氢钠占原碳酸氢钠的质量分数为_____。(已知:
,则分解的碳酸氢钠占原碳酸氢钠的质量分数为_____。(已知:![]() )
)
【答案】导电 ![]()
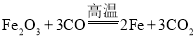 BD 40%
BD 40%
【解析】
(1)由于铜具有良好的导电性,所以铜常用于制作导线。
(2)铝在空气中与氧气反应生成致密的氧化铝薄膜,表现出良好的抗腐蚀性能,反应放热化学方程式为![]() 。
。
(3)CO与Fe2O3反应生成Fe和CO2,反应的方程式为: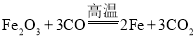 。
。
(4)向![]() 、
、![]() 、
、![]() 的混合溶液中,加入一定量的铁粉,根据活动性顺序,铁先与硝酸银反应,再与硝酸铜反应,铁不与硝酸镁反应,充分反应后过滤,滤液呈蓝色,说明滤液中仍有
的混合溶液中,加入一定量的铁粉,根据活动性顺序,铁先与硝酸银反应,再与硝酸铜反应,铁不与硝酸镁反应,充分反应后过滤,滤液呈蓝色,说明滤液中仍有![]() ,此时铁一定反应完,溶液中可能有硝酸银,一定有硝酸亚铁、硝酸铜、硝酸镁。
,此时铁一定反应完,溶液中可能有硝酸银,一定有硝酸亚铁、硝酸铜、硝酸镁。
A、铁已经反应完全,故向滤渣中加入稀盐酸,不可能有气泡产生,A错误;
B、滤液中一定含有![]() 、
、![]() 和
和![]() ,B正确;
,B正确;
C、根据关系式![]() ,
,![]() ,固体质量增大,与原溶液相比,滤液的质量减小,C错误;
,固体质量增大,与原溶液相比,滤液的质量减小,C错误;
D、滤液中可能有硝酸银,向滤液中滴入稀盐酸,可能会有白色沉淀出现,D正确。故选BD。
(5)样品中碳酸氢钠的质量为:100g×23%÷![]() =84g
=84g
设分解的碳酸氢钠的质量为x,
![]()
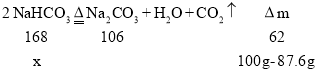
![]() ,x=33.6g
,x=33.6g
分解的碳酸氢钠占原碳酸氢钠的质量分数为![]() =40%。
=40%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(一)某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
(猜想与假设)
其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
(资料查阅)上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下某稀溶液的pH | 7 | 13 | 11 | 9 |
(探究过程)
如图乙所示,在操作①后可确定溶质不是NaCl,则实验现象应是__________;在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的____________。
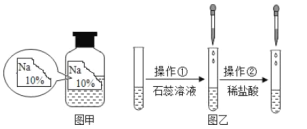
(探究结论)
你认为该溶液中的溶质可能是上述假设物质中的_________,你的判断依据是_________。
(探究反思)若上述探究结论是正确的,操作②产生的气体应是_______(写化学式),实验室检验该气体的原理是(用化学方程式表示)_______。
(二)兴趣小组同学在做镁条和盐酸反应实验时发现,试管外壁很烫,试管口出现白雾。白雾是什么呢?
Ⅰ.同学们作出猜想
猜想一:是小水滴。因为盐酸溶液中的水受热会汽化上升,在试管口____(填物态变化名称)成小水滴。
猜想二:是盐酸小液滴。因为浓盐酸具有____性,可能实验中使用的盐酸浓度过高,试管口就会形成盐酸小液滴。同学们将干燥的蓝色石蕊试纸放在内有正在反应的镁条和盐酸的试管口,试纸变红,证明猜想二是合理的。
Ⅱ.小柯提出质疑
为什么刚才打开盛放实验所用盐酸的试剂瓶,瓶口没有白雾,却在反应过程中出现白雾?小柯联系反应时试管外壁很烫,于是猜想:白雾的形成可能与温度有关。
他用试管取少量盐酸,将干燥的蓝色石蕊试纸放在试管口,试纸不变红;然后__________(填操作),试纸变红。
得出结论:这种盐酸浓度并不高,是因_______促使盐酸形成白雾。