题目内容
实验室用溶质质量分数为5%的过氧化氢溶液与二氧化锰混合制取氧气.若要制取1.6g氧气,理论上需要该过氧化氢溶液的质量是多少?(请写出计算过程)
68g
解析试题分析:设需要过氧化氢的质量x.
2H2O2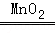 2H2O+O2↑
2H2O+O2↑
68 32
x 1.6g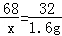
解得:x=3.4g
所以理论上需要该过氧化氢溶液的质量是:3.4g÷5%=68g
答:理论上需要该过氧化氢溶液的质量是68g.
考点:根据化学反应方程式的计算.
点评:利用溶液中溶质质量分数= ×100%,由溶质的质量及溶液的质量分数可计算溶液的质量.
×100%,由溶质的质量及溶液的质量分数可计算溶液的质量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
质量法是化学实验中测定物质组成时常用的一种方法。现有11 g气体,经测含碳元素3g,其余都是氧元素。下列有关说法正确的是
| A.气体可能是CO2和O2的混合物 |
| B.气体可能是CO和CO2的混合物 |
| C.气体组成有4种情况 |
| D.若气体由三物质组成,则三物质质量比可能是7:3:4 |