题目内容
(2003?济宁)某气体可能是氢气或一氧化碳气体,也可能是氢气与一氧化碳的混合气体.为确定其组成将该气体通过灼热的氧化铜后(装置见如图),得到如下实验结果:| 实验前 | 实验后 | |
| 氧化铜+玻璃管 | 65.6g | 62.4g |
| 氯化钙+U型管 | 100.8g | 102.6g |
(1)该气体中含有______.
(2)若该气体为混合物,则氢气与一氧化碳两种气体的质量比为______.

【答案】分析:氢气还原氧化铜生成了水,一氧化碳还原氧化铜生成了二氧化碳,由氧化铜和玻璃管在反应前后质量的变化可得到氧化铜中氧元素的质量为:65.6g-62.4g=3.2g,又根据氯化钙干燥剂增加的质量即水的质量为:102.6g-100.8g=1.8g,1.8g水中氧元素的质量为:1.8× ×100%=1.6g,所以可知生成的气体还有二氧化碳,即还有CO还原了氧化铜,CO夺取了氧元素的质量为:3.2-1.6=1.6g,从而可求出氢气的质量为:1.8-1.6=0.2g,用差量法即可求出CO的质量.
×100%=1.6g,所以可知生成的气体还有二氧化碳,即还有CO还原了氧化铜,CO夺取了氧元素的质量为:3.2-1.6=1.6g,从而可求出氢气的质量为:1.8-1.6=0.2g,用差量法即可求出CO的质量.
解答:解:(1)氧化铜失去氧元素的质量为:65.6g-62.4g=3.2g
生成水的质量为:102.6g-100.8g=1.8g
1.8g水中氧元素的质量为:1.8×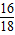 ×100%=1.6g<3.2g
×100%=1.6g<3.2g
所以生成物不仅仅是水,还有二氧化碳,即混合物中有CO
故答案为:H2、CO
(2)CO夺取了氧元素的质量为:3.2-1.6=1.6g,
从而求出氢气的质量为:1.8-1.6=0.2g,
CO质量为: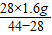 =2.8g,
=2.8g,
所以氢气与一氧化碳两种气体的质量比为:0.2:2.8=1:14.
所以答案为:1:14
点评:本题为数据分析题,关键是把握住氧化铜中数去氧元素的质量,然后求出水中氧元素的质量,从而断定有一氧化碳的存在,继而求出CO的质量;本题在于考查学生的数据分析能力和计算能力.
 ×100%=1.6g,所以可知生成的气体还有二氧化碳,即还有CO还原了氧化铜,CO夺取了氧元素的质量为:3.2-1.6=1.6g,从而可求出氢气的质量为:1.8-1.6=0.2g,用差量法即可求出CO的质量.
×100%=1.6g,所以可知生成的气体还有二氧化碳,即还有CO还原了氧化铜,CO夺取了氧元素的质量为:3.2-1.6=1.6g,从而可求出氢气的质量为:1.8-1.6=0.2g,用差量法即可求出CO的质量.解答:解:(1)氧化铜失去氧元素的质量为:65.6g-62.4g=3.2g
生成水的质量为:102.6g-100.8g=1.8g
1.8g水中氧元素的质量为:1.8×
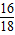 ×100%=1.6g<3.2g
×100%=1.6g<3.2g所以生成物不仅仅是水,还有二氧化碳,即混合物中有CO
故答案为:H2、CO
(2)CO夺取了氧元素的质量为:3.2-1.6=1.6g,
从而求出氢气的质量为:1.8-1.6=0.2g,
CO质量为:
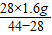 =2.8g,
=2.8g,所以氢气与一氧化碳两种气体的质量比为:0.2:2.8=1:14.
所以答案为:1:14
点评:本题为数据分析题,关键是把握住氧化铜中数去氧元素的质量,然后求出水中氧元素的质量,从而断定有一氧化碳的存在,继而求出CO的质量;本题在于考查学生的数据分析能力和计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
