题目内容
氢氧化铝也叫铝酸(H3AlO3),它可以与氢氧化钠(NaOH)反应,其反应的方程式为:H3AlO3+3NaOH=3NaAlO2+3H2O,该反应属于( )
分析:根据反应的化学方程式进行判断,化合反应是两种或两种以上的物质生成一种物质的化学反应,分解反应是一种物质生成两种或两种以上物质的化学反应,置换反应是一种单质与一种化合物生成另一种单质和另一种化合物的反应,复分解反应是两种化合物互相交换成分,生成两种新的化合物的反应.
解答:解:A、此反应生成两种物质,不是化合反应,故A错误;
B、此反应的反应物是两种,不是分解反应,故B错误;
C、此反应的反应物是两种化合物,不是置换反应,故C错误;
D、此反应是铝酸与氢氧化钠互相交换成分,生成两种新的化合物的反应,属于复分解反应,故D正确;
故选D.
B、此反应的反应物是两种,不是分解反应,故B错误;
C、此反应的反应物是两种化合物,不是置换反应,故C错误;
D、此反应是铝酸与氢氧化钠互相交换成分,生成两种新的化合物的反应,属于复分解反应,故D正确;
故选D.
点评:本题考查了反应类型的判断,完成此题,可以依据反应的方程式结合反应类型的特点进行.

练习册系列答案
相关题目
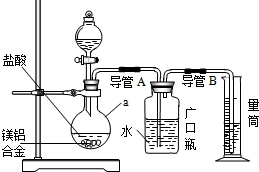 含镁3%一5%的镁铝合金是轮船制造、化工生产、机械制造等行业的重要原材料.现有一块质量为W 9的镁铝合金,某研究性学习小组欲测定其中镁的质量分数.
含镁3%一5%的镁铝合金是轮船制造、化工生产、机械制造等行业的重要原材料.现有一块质量为W 9的镁铝合金,某研究性学习小组欲测定其中镁的质量分数.