题目内容
【题目】红枣中含有丰富的VC和糖类,常食能增强人体的免疫力,有补血养气安神等良好功效,红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如下图所示。某化学兴趣小组对一包久置的“504双吸剂”固体样品产生浓厚的兴趣,设计实验进行探究。

【提出问题】久置固体的成分是什么?
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
【实验探究】甲同学的方案:
实验操作 | 实验现象 | 实验结论 |
加足量的_________。 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液。 | 固体中一定含有__________, 一定不含Fe2O3。 |
乙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是___ 。
他设计如下实验方案继续验证。
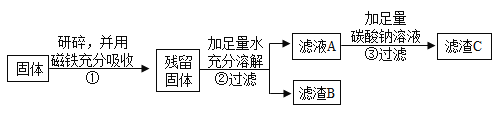
(1)步骤①样品用磁铁吸引前需经过研碎,其中研碎的目的是 ;
(2)②中固体溶解时放出大量热,由此可以判断固体中一定含有____ ____。
(3)③中反应的化学方程式是_____ ____。
乙同学对滤渣B又进行探究。
实验操作 | 实验现象 | 实验结论 |
取少量固体于试管中,滴加足量的稀盐酸,并将气体通入澄清石灰水 | 固体逐渐消失有气泡产生、_______ ___________ ___。 | 固体中一定含有CaCO3和Fe2O3。 |
【反思与评价】甲、乙两同学经过讨论后,完善实验方案最终确定该久置固体的成分是Fe、Fe2O3、CaO、CaCO3。
【答案】甲同学的方案: 稀盐酸(或稀硫酸) Fe(或铁粉)
乙同学的理由:氧化铁与稀盐酸(或稀硫酸)反应生成的氯化铁(或硫酸铁)又与铁粉反应生成氯化亚铁(或硫酸亚铁)。
(1)增大接触面积,使得铁粉能够充分吸引 (2)CaO(或氧化钙)
(3)Ca(OH)2+Na2CO3==CaCO3↓+2NaOH;乙同学的探究:澄清石灰水变浑浊 溶液呈黄色
【解析】
试题分析:甲同学的方案:取少量固体放于试管中,滴加足量的稀盐酸,固体逐渐消失,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁。
乙同学的理由查阅资料:氧化铁与稀盐酸(或稀硫酸)反应生成的氯化铁(或硫酸铁)又与铁粉反应生成氯化亚铁(或硫酸亚铁)。
(1)增大接触面积,使得铁粉能够充分吸引(2)氧化钙溶于水放出大量的热量
(3)生成的氢氧化钙与碳酸钠溶液反应Ca(OH)2+Na2CO3==CaCO3↓+2NaOH;固体中含有CaCO3和Fe2O3。都会与盐酸反应,CaCO3与盐酸反应产生CO2使澄清石灰水变浑浊,Fe2O3与盐酸产生氯化铁为黄色。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案