题目内容
【题目】木炭还原氧化铜实验后的混合粉末中含有铜、氧化铜、木炭粉,某化学实验小组设计回收金属铜的方案如下:
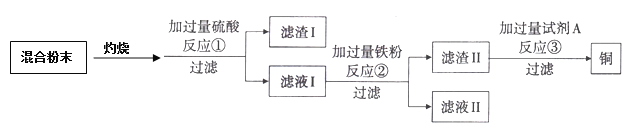
(1)上述过滤操作中玻璃棒的作用是 。
(2)写出混合粉末在空气中灼烧时发生的其中一个反应方程式 。
(3)反应①的现象为 ,滤液Ⅰ中的溶质为 。写出反应②中的1个化学方程式 。
(4)试剂A一般选用的溶液是 (填溶质的化学式)。
【答案】(1)引流
(2)C+O2![]() CO2;
CO2;
(3)溶液由无色变为蓝色,CuSO4 H2SO4。Fe+H2SO4=FeSO4+H2↑。
(4)H2SO4
【解析】
试题分析:将混合粉末灼烧,那么碳能与氧气反应生成二氧化碳,铜能与氧气反应生成氧化铜。加入过量的稀硫酸,稀硫酸能与氧化铁反应生成硫酸铜和水,通过过滤的方法可将固体和硫酸铜溶液分离;由于加入的硫酸是过滤的,即刘烨1中含有硫酸铜和硫酸。加入过量的铁粉,铁能与硫酸反应生成硫酸亚铁和氢气,还能与硫酸铜反应生成铜和硫酸亚铁,通过过滤可将硫酸亚铁分离。由于加入的铁粉是过滤的,故滤渣2中含有铜和铁,铁能与酸反应,但铜不能,故可加入过量的稀硫酸将铜粉中的铁除去,得到纯净的铜。
(1)操作1是过滤,过滤时玻璃棒起引流的作用;
(2)碳能与氧气反应生成二氧化碳,铜能与氧气反应生成氧化铜。反应的化学方程式为;C+O2![]() CO2;
CO2;
(3)氧化铜与稀硫酸反应生成硫酸铜和水,现象是溶液由无色变为蓝色;滤液Ⅰ中的溶质为CuSO4 和H2SO4;铁和稀硫酸反应生成硫酸亚铁和氢气:Fe+H2SO4=FeSO4+H2↑;
(4)滤渣2中含有铜和铁,铁能与酸反应,但铜不能,故可加入过量的稀硫酸将铜粉中的铁除去,得到纯净的铜。

【题目】区分下列各组物质的两种方法都正确的是
选项 | A | B | C | D |
需区分的物质 | 矿泉水和蒸馏水 | 空气和呼出气体 | 氯化钠和硝酸铵 | 纯棉制品和涤纶制品 |
方案一 | 加肥皂水搅拌 | 带火星的木条 | 加适量水溶解后测温度变化 | 观察颜色 |
方案二 | 观察颜色 | 澄清石灰水 | 加熟石灰研磨,闻气味 | 灼烧闻气味 |