题目内容
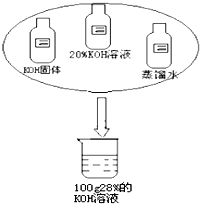 同学们在进行实验探究活动中需要100克28%的KOH溶液.
同学们在进行实验探究活动中需要100克28%的KOH溶液.(1)提供如图所示的足量药品,仔细观察,认真设计配制溶液的方案(要说明所需的各种药品用量)填入下表中.
| 方案 | 药品用量 |
| 方案一:将20%的KOH溶液蒸发水分 | 需20%的KOH溶液 |
| 方案二:用KOH固体来配置该溶液 | 需KOH固体 |
①上述反应中产生沉淀的质量;②无色滤液中,溶质的质量分数.
分析:(1)配制溶质质量分数为28%的氢氧化钾溶液,可根据题中数据并结合溶质的质量=溶液的质量×溶质的质量分数计算出所需要各种物质的用量,完成实验方案的设计;
(2)根据氢氧化钾的质量利用化学方程式可以求出参加反应的硫酸铜的质量以及生成蓝色沉淀氢氧化铜质量和硫酸钾的质量,然后利用溶质质量分数公式计算即可.
(2)根据氢氧化钾的质量利用化学方程式可以求出参加反应的硫酸铜的质量以及生成蓝色沉淀氢氧化铜质量和硫酸钾的质量,然后利用溶质质量分数公式计算即可.
解答:解:(1)方案一:设需20%的K0H溶液的质量为x,根据溶质的关系 100g×28%=x×20%,可得x=140g;
方案二:需KOH固体的质量是:100g×28%=28g,需蒸馏水的质量是100g-28g=72g;
故答案为:
(2)①设出参加反应的硫酸铜的质量为x,生成蓝色沉淀氢氧化铜质量为y,生成硫酸钾的质量为z.
2KOH+CuSO4=K2SO4 +Cu(OH)2↓
112 160 174 98
100g×28% x z y
=
x=40g
=
y=24.5g
=
z=43.5g
②32%硫酸铜溶液的质量=
=125g
无色滤液中,溶质的质量分数=
×100%=21.7%
答:①上述反应中产生沉淀的质量为24.5g;②无色滤液中,溶质的质量分数为21.7%.
方案二:需KOH固体的质量是:100g×28%=28g,需蒸馏水的质量是100g-28g=72g;
故答案为:
| 方案 | 药品用量 |
| 方案一:将20%的KOH溶液蒸发水分 | 需20%的KOH溶液140g |
| 方案二:用KOH固体来配制该溶液 | 需KOH固体28g,需蒸馏水72g |
2KOH+CuSO4=K2SO4 +Cu(OH)2↓
112 160 174 98
100g×28% x z y
| 112 |
| 100g×28% |
| 160 |
| x |
x=40g
| 112 |
| 100g×28% |
| 98 |
| y |
y=24.5g
| 112 |
| 100g×28% |
| 174 |
| z |
z=43.5g
②32%硫酸铜溶液的质量=
| 40g |
| 32% |
无色滤液中,溶质的质量分数=
| 43.5g |
| 100g+125g-24.5g |
答:①上述反应中产生沉淀的质量为24.5g;②无色滤液中,溶质的质量分数为21.7%.
点评:了解溶质的质量=溶液的质量×溶质的质量分数,水的质量=溶液的质量-溶质的质量并结合题意分析解答.

练习册系列答案
相关题目
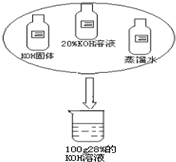 同学们在进行实验探究活动中需要100克28%的KOH溶液.现提供如图所示的足量药品,仔细观察,认真设计配制溶液的方案(要说明所需的各种药品用量)填入下表中.
同学们在进行实验探究活动中需要100克28%的KOH溶液.现提供如图所示的足量药品,仔细观察,认真设计配制溶液的方案(要说明所需的各种药品用量)填入下表中.
| 方案 | 药品用量 |
| 方案一:将20%的KOH溶液蒸发水分 | 需20%的KOH溶液________g |
| 方案二:用KOH固体来配制该溶液 | 需KOH固体________g,需蒸馏水________g |
同学们在进行实验探究活动中需要100克28%的KOH溶液。
(1)提供如图所示的足量药品,仔细观察,认真设计配制溶液的方案(要说明所需的各种药品用量)填入下表中。
方案 | 药品用量 |
方案一:将20%的KOH溶液蒸发水分 | 需20%的KOH溶液 g |
方案二:用KOH固体来配置该溶液 | 需KOH固体 g,需蒸馏水 g |
(2)向上述100g28%的KOH溶液中加入一定质量的32%硫酸铜溶液,反应恰好完全,过滤,得到无色滤液和蓝色沉淀。请通过计算回答下列问题:
①上述反应中产生沉淀的质量;
②无色滤液中,溶质的质量分数。

同学们在进行实验探究活动中需要100克28%的KOH溶液.现提供如图所示的足量药品,仔细观察,认真设计配制溶液的方案(要说明所需的各种药品用量)填入下表中.

| 方案 | 药品用量 |
| 方案一:将20%的KOH溶液蒸发水分 | 需20%的KOH溶液______g |
| 方案二:用KOH固体来配制该溶液 | 需KOH固体______g,需蒸馏水______g |

 (2006?栖霞区三模)同学们在进行实验探究活动中需要100克28%的KOH溶液.现提供如图所示的足量药品,仔细观察,认真设计配制溶液的方案(要说明所需的各种药品用量)填入下表中.
(2006?栖霞区三模)同学们在进行实验探究活动中需要100克28%的KOH溶液.现提供如图所示的足量药品,仔细观察,认真设计配制溶液的方案(要说明所需的各种药品用量)填入下表中.