题目内容
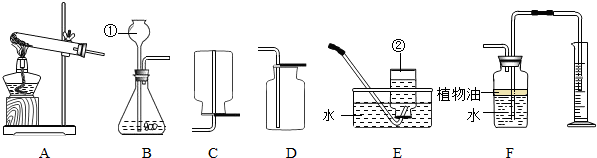
(24分)下图所示为实验室常用的实验装置:

(1)写出下列仪器名称:a ;b 。
(2)实验室用高锰酸钾制取氧气时,应选择的发生装置是 (填装置的字母代号),化学方程式是 ,用双氧水制取氧气的化学方程式为 。
(3)实验室用锌和稀硫酸反应制取氢气的化学方程式是 ,若将E装置中收集的氢气排出,应从 (填c或d)口通入蒸馏水。
(4)装置C相对于装置B在操作方面的优势为 。
A.可以随时加液 B.可以控制反应速率 C.可以控制反应发生与停止
同学们对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究:
[拓展实验一] 探究影响石头纸与盐酸反应快慢的因素
(5)甲、乙两同学设计实验如下:
|
|
甲 |
乙 |
|
实验过程 |
|
|
|
现象 |
试管①、②、③中产生气泡快慢的顺序为: ①>②>③。 |
|
|
分析结论 |
Ⅰ 碳酸钙与稀盐酸反应的化学方程式为 Ⅱ 对比甲同学实验①②可知, ,化学反应的速度越快; Ⅲ 对比甲同学实验 (填实验序号)可知,反应物的接触面积越大,反应速率越。 Ⅳ 乙同学的实验中,数据记录纸上应该连续记录的实验数据是 和 。 |
[拓展实验二] 测定石头纸中碳酸钙的质量分数
(6)甲组同学的方法是:(同温同压下,不同气体混合后体积等于混合前各气体体积之和。)
将样品与稀盐酸反应,测定反应后生成CO2的体积,再换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量。下图(Ⅰ)为石头纸与稀盐酸反应的装置,图(Ⅱ)用于测量CO2的体积。

① 连接仪器,夹紧弹簧夹,向a中加入一定量的水,如果a、b中有稳定的高度差,说明:装置(I)气密性 (选填“良好”或“漏气”)
② 图(Ⅱ)装置中油层的作用是_ ;
③ 反应停止后, (填序号)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积。
A. 水平移动量气管 B.上下移动量气管 C. 封闭量气管
(7) 乙组同学的实验方法是:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如下表。(其他物质既不溶于水也不跟酸反应)
|
|
第一份 |
第二份 |
第三份 |
第四份 |
|
取样品质量(g) |
6.25 |
6.25 |
6.25 |
6.25 |
|
取稀盐酸的体积(mL) |
10.0 |
20.0 |
30.0 |
40.0 |
|
产生气体的质量(g) |
0.88 |
1.76 |
2.20 |
m |
通过对数据的分析和比较,回答下列有关问题:
① 在第1份样品的实验中, 完全反应了。
② m为
③ 石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程,4分)
④ 请在坐标图中画出在6.25 g样品中加入稀盐酸的体积与产生气体质量的关系图。 
(1)a酒精灯,b长颈漏斗
(2)A 2KMnO4 K2MnO4 +MnO2+O2↑
2H2O2
K2MnO4 +MnO2+O2↑
2H2O2 2H2O+O2↑
2H2O+O2↑
(3)Zn + H2SO4 ="=" ZnSO4 + H2↑ d
(4) C
(5)ⅠCaCO3+2HCl=CaCl2+H2O+CO2↑ Ⅱ盐酸越浓(溶质质量分数越大) Ⅲ ②③ 快
Ⅳ时间(计时器示数),锥形瓶及药品的质量(电子天平示数)或CO2质量
(6)①良好 ②防止CO2溶于水、与水反应或隔绝CO2与水 ③ B
(7)①盐酸(HCl)②2.20 ③80%
④

【解析】
试题分析:(1)根据实验常用仪器回答,图中仪器a的名称是酒精灯,b是长颈漏斗。
(2)根据反应物的状态和反应条件选择发生装置,实验室用固体高锰酸钾加热分解制取氧气,故属于“固体加热型”,故制取装置应选A;加热高锰酸钾分解制取氧气的同时,还生成了锰酸钾、二氧化锰,故反应的化学方程式是2KMnO4 K2MnO4 +MnO2 +
O2↑;双氧水在二氧化锰的催化作用下,分解生成水和氧气,故反应的化学方程式为2H2O2
K2MnO4 +MnO2 +
O2↑;双氧水在二氧化锰的催化作用下,分解生成水和氧气,故反应的化学方程式为2H2O2 2H2O+O2↑
2H2O+O2↑
(3)锌和稀硫酸反应生成硫酸锌和氢气,故反应的化学方程式是Zn + H2SO4=ZnSO4+ H2↑,由于氢气的密度比空气小,应用向下排空气法收集,故氢气应从d端进入,把集气瓶内的空气向下从c压出。
(4)装置C相对于装置B多了一个多孔的塑料片,当关闭止水夹后,大量的氢气因无法排出而使试管内的压强增大,可将液体压入长颈漏斗,而试管内的酸液则降至塑料片以下,固液体分离,反应停止;打开止水夹,液体进入试管,固液体重新接触,反应继续进行,产生氢气,即能随开随用、随关随停。故选C
(5)Ⅰ 碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,故反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
Ⅱ对比实验①②,只有所用盐酸的浓度不同,故可得出反应物的浓度越大,化学反应的速度越快;
Ⅲ对比实验②③,反应物的接触面不同(一个为粉末,一个为团状),可知,反应物的接触面积越大,化学反应的速度越快;
Ⅳ根据操作示意图,实验过程中对锥形瓶内所剩余物质的质量进行称量,由此得到反应时间与放出二氧化碳的质量关系,即连续记录的实验数据是:电子天平示数(或锥形瓶体系质量)和计时器示数(或反应时间)。
(6)①根据题意,a、b中有稳定的高度差,说明试管内压强大于外界大气压,即说明气密性良好;
②由于二氧化碳能溶于水,且随压强增大而溶解的量变大,故油层能防止CO2溶于水、与水反应;
③若使反应前后油层上方气体压强和外界大气压相同,根据物理压强平衡的原理,只要使两侧的液面齐平即可,故选B。
(7)①通过第1份和第2份比较可以发现,当稀盐酸的质量增加时,气体的质量也在增加,说明第1份中碳酸钙没有完全反应,则稀盐酸完全反应;
②第1份放出二氧化碳的质量0.88g,说明每加入10g稀盐酸与碳酸钙完全反应,产生二氧化碳的质量为0.88g;第2份加入20g盐酸,是第一份稀盐酸质量的2倍,产生二氧化碳的质量为1.76g,也正是第一份产生气体质量的2倍;而第三份加入30g盐酸,是第一份稀盐酸质量的3倍,产生二氧化碳的质量为2.2g,小于第一份产生气体的质量的3倍(0.88g×3=2.56g),说明碳酸钙此时完全反应,稀盐酸有剩余,则第四份的盐酸不反应,故m的值为2.2;
③解:设6.25g 样品中CaCO3的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2g
100:44= x:2.2g
解得,x=5g
则CaCO3的质量分数为=  ×100% ="80%"
×100% ="80%"
④找出起点、最大值、折点、曲线的走势,画出图象即可。

考点:常用气体的发生装置和收集装置与选取方法,实验室制取氧气的反应原理,制取氧气的操作步骤和注意点,二氧化碳的化学性质,书写化学方程式,氢气的制取和检验,实验探究物质的组成成分以及含量,检查装置的气密性,根据化学反应方程式的计算
点评:本题是一道综合实验题,是课本实验的有效延伸,除了要求学生要具备扎实的基础知识和基本实验技能之外,还要有较强的识图能力和数据分析能力,和对于科学实验的实事求是的精神,能够综合分析和解决实际问题,这也是正确解答此类题的关键。

 名校课堂系列答案
名校课堂系列答案