题目内容
某化学课外小组活动成员小强、小明和小华三位同学在学习了木炭还原氧化铜的实验后,提出如下问题:“木炭与一氧化铅
(化学式为PbO)反应生成铅的同时产生的气体一定全部为二氧化碳吗?”请你和他们一起对产生的气体分进行研究,并回答有关问题:(1)
猜想:小强认为:反应产生的气体全部为二氧化碳.小明认为:反应产生的气体全部为一氧化碳.
小华认为:反应产生气体既有二氧化碳又有一氧化碳.
(2)
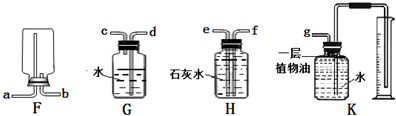
设计实验:根据各自的猜想,他们共同设计了实验,实验装置如图所示(他们在实验中进行了规范操作和细致的观察).(3)
现象与结论:如果小强猜想正确,装置B、C中的实验现象是___________;如果小明猜想正确,装置B、C中的实验现象是___________________;(4)
此实验装置有不足之处,请你对该装置进行改进,具体措施是_______________;(5)
根据上述实验及木炭与CuO、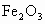 的反应,请你归纳出单质炭的一项重要用途是________________.
的反应,请你归纳出单质炭的一项重要用途是________________.

答案:略
解析:
解析:
|
(1) 、(2)略(3) 澄清的石灰水变浑浊、鸡血颜色不变 澄清的石灰水无明显变化,鸡血颜色发生变化了(4) 装置C的出气口接一尖嘴玻璃管和燃着的酒精灯(或在装置C的出气口用气球或塑料袋收集尾气)(5) 冶炼金属分析实验装置中的 B、C部分的作用:B瓶中的澄清的石灰水是为验证生成的气体中含有二氧化碳并把它吸收掉;C试管中新鲜鸡血是为了检验生成的气体中是否含有一氧化碳.因为一氧化碳能与血液中的血红蛋白结合使血液颜色改变.如果小强的猜想正确生成物全部为二氧化碳,则澄清的石灰水变浑浊,新鲜鸡血不变色;如果小明的猜想正确生成物全部为一氧化碳,则澄清的石灰水无明显变化,鸡血的颜色改变.由于实验中产生的CO与新鲜鸡血不能完全反应,CO逸出后直接排放到空气中容易造成污染,因此要有尾气处理装置.由于  与 与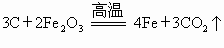 反应中,碳夺得了含氧化合物中的氧起到了还原剂的作用,所以推测其用途,可能为冶金工业的还原剂. 反应中,碳夺得了含氧化合物中的氧起到了还原剂的作用,所以推测其用途,可能为冶金工业的还原剂. |

练习册系列答案
相关题目
 环境保护是一个全球性的话题,作为对世界影响力最大的体育盛会--奥林匹克运动会,长期以来,在环保方面给世人留下的似乎是麻烦.2008年奥运,我国承诺“绿色奥运”.本次奥运会环保标志由人与绿树为主要形态.绿色的线条形如舞动的彩带,环绕交错,一笔描出,仿佛茂密的树冠,又似盛开的花朵,充满无限生机和希望,充分体现了自然环保的可持续性发展.树冠与人组成参天大树,代表着人与自然的和谐统一.
环境保护是一个全球性的话题,作为对世界影响力最大的体育盛会--奥林匹克运动会,长期以来,在环保方面给世人留下的似乎是麻烦.2008年奥运,我国承诺“绿色奥运”.本次奥运会环保标志由人与绿树为主要形态.绿色的线条形如舞动的彩带,环绕交错,一笔描出,仿佛茂密的树冠,又似盛开的花朵,充满无限生机和希望,充分体现了自然环保的可持续性发展.树冠与人组成参天大树,代表着人与自然的和谐统一.我们在初中化学学习的过程中接触了许多与环境保护有关的知识.
(一)空气污染与保护
(Ⅰ)二氧化碳是大气中的主要温室气体,我国二氧化碳的排放量位居世界第二.为减少空气中二氧化碳这种温室气体,我们可以采取的措施有(只填2种):
(Ⅱ)为减缓二氧化碳使全球变暖的趋势,有科学家提出大胆设想:将排放到空气中的二氧化碳压缩使其液化,然后将其压入到冰冷的深海中.但也有科学家担心海水中富含二氧化碳后酸度会增加,可能会杀死一些海洋生物,甚至会溶解掉部分海床,同时气候变化也可能改变海洋环流,把海底的二氧化碳又带回海面,另外把二氧化碳压入海底所消耗的能源可能会再增加二氧化碳的排放.
(1)实现二氧化碳液化,压缩过程将会
(2)二氧化碳使海水酸度增加的原理用化学方程式表示为:
(3)二氧化碳在深海中的溶解度
(二)水污染与保护
近几年我国不少水域多次发生“赤潮”、“水华”现象,这是水中的藻类生长繁殖过快导致的水质恶化现象.
(Ⅰ)河水的微生物使有机物(假设以C6H10O5表示)转化成二氧化碳和水的过程所需氧气的量叫生化需氧量(简称BOD),BOD是衡量水体质量的一个指标.写出C6H10O5和氧气反应的化学方程式
(Ⅱ)某化学兴趣小组在课外活动中,对某工厂排放出的无色废水进行了多次检测,其中三次检测结果如下表所示,请回答:
| 检测次数 | 废液中检测出的物质 |
| 第一次 | KNO3、Ba(NO3)2、Cu(NO3)2、HNO3 |
| 第二次 | KNO3、Ba(NO3)2、Mg(NO3)2、HNO3 |
| 第三次 | KNO3、Ba(NO3)2、AgNO3、HNO3 |
(2)在检测时,为了确定该工厂排放的废液中到底是否含有Mg2+、Ag+,该兴趣小组的同学作了进一步检验:取样,向其中加入
(3)加入适量的KOH,可以将废液中的Mg(NO3)2、HNO3除去,再加入适量的草木灰提取物(主要成分为碳酸钾,其余成分不参与反应),可以将废液中的Ba(NO3)2除去,并得到一种复合肥料,该复合肥料为
(4)为了防止废液中的钡离子污染环境,该兴趣小组提出了用草木灰提取物处理废水后再排放的建议.他们通过测定得知,该工厂排放出来的废水中Ba(NO3)2的质量分数为2.61%,已知该厂每天排放的废水为100吨,请通过计算确定每天需要多少吨K2CO3含量为30%的草木灰提取物,才能将废水中的钡离子除去?