题目内容
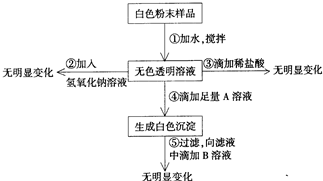 一包白色粉末可能含NaCl、Na2SO4、Na2CO3、FeCl3、MgCl2中一种或几种,为鉴定其组成,现按照如图做实验:
一包白色粉末可能含NaCl、Na2SO4、Na2CO3、FeCl3、MgCl2中一种或几种,为鉴定其组成,现按照如图做实验:
根据图回答:
(1)原白色粉末一定含______,一定不含______;
(2)所用溶液中溶质的化学式:A______,B______.
解:①取样加水溶解,得到无色透明溶液,氯化铁的水溶液为黄色,说明一定无氯化铁,氯化镁能与碳酸钠反应生成白色沉淀,说明碳酸钠和氯化镁不能同时存在;②向无色透明溶液加入NaOH溶液,观察,没有明显现象,说明无氯化镁,③向无色透明溶液,滴加稀盐酸,观察,也没有明显现象,说明无碳酸钠;④为证明氯化钠和硫酸钠的存在情况,即验证氯离子或硫酸根离子的存在,为排除硫酸根离子对氯离子检验的干扰,应该先鉴别硫酸根离子,因此滴加A溶液产生沉淀,A溶液是硝酸钡,产生白色沉淀,说明含有硫酸钠;⑤继续向滤液中滴加B溶液,即验证氯离子的存在,因此B是硝酸银溶液,无现象,说明没有氯化钠.
故答案为:(1)一定含Na2SO4;一定不含Na2CO3、NaCl、FeCl3、MgCl2;
(2)A.Ba(NO3)2;B.AgNO3.
分析:根据实验现象结合物质的性质及物质间的反应进行分析,①取样加水溶解,得到无色透明溶液,氯化铁的水溶液为黄色,说明一定无氯化铁,氯化镁能与碳酸钠反应生成白色沉淀,说明碳酸钠和氯化镁不能同时存在;②向无色透明溶液加入NaOH溶液,观察,没有明显现象,说明无氯化镁,③向无色透明溶液,滴加稀盐酸,观察,也没有明显现象,说明无碳酸钠;④为证明氯化钠和硫酸钠的存在情况,即验证氯离子或硫酸根离子的存在,为排除硫酸根离子对氯离子检验的干扰,应该先鉴别硫酸根离子,因此滴加A溶液产生沉淀,A溶液是硝酸钡,产生白色沉淀,说明含有硫酸钠;⑤继续向滤液中滴加B溶液,即验证氯离子的存在,因此B是硝酸银溶液,无现象,说明没有氯化钠.
点评:本题属于框图式的推断题,依据图示的操作及物质的性质、物质间的反应逐渐得出结论;在验证硫酸根离子和氯离子的时候,要注意操作的顺序及加入的试剂不能互相产生干扰.
故答案为:(1)一定含Na2SO4;一定不含Na2CO3、NaCl、FeCl3、MgCl2;
(2)A.Ba(NO3)2;B.AgNO3.
分析:根据实验现象结合物质的性质及物质间的反应进行分析,①取样加水溶解,得到无色透明溶液,氯化铁的水溶液为黄色,说明一定无氯化铁,氯化镁能与碳酸钠反应生成白色沉淀,说明碳酸钠和氯化镁不能同时存在;②向无色透明溶液加入NaOH溶液,观察,没有明显现象,说明无氯化镁,③向无色透明溶液,滴加稀盐酸,观察,也没有明显现象,说明无碳酸钠;④为证明氯化钠和硫酸钠的存在情况,即验证氯离子或硫酸根离子的存在,为排除硫酸根离子对氯离子检验的干扰,应该先鉴别硫酸根离子,因此滴加A溶液产生沉淀,A溶液是硝酸钡,产生白色沉淀,说明含有硫酸钠;⑤继续向滤液中滴加B溶液,即验证氯离子的存在,因此B是硝酸银溶液,无现象,说明没有氯化钠.
点评:本题属于框图式的推断题,依据图示的操作及物质的性质、物质间的反应逐渐得出结论;在验证硫酸根离子和氯离子的时候,要注意操作的顺序及加入的试剂不能互相产生干扰.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
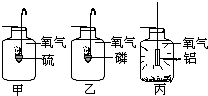 甲、乙、丙是三个实验的示意图,根据图中所发生的化学反应现象及化学反应原理,进行总结归纳并回答下列问题:
甲、乙、丙是三个实验的示意图,根据图中所发生的化学反应现象及化学反应原理,进行总结归纳并回答下列问题: ,则应加入水为 ______g.
,则应加入水为 ______g.