题目内容
某兴趣小组对硫酸厂排放的废水中硫酸含量进行检测:
(1)配制溶液:配制溶质质量分数为4%的NaOH溶液20g,需要NaOH固体 g,水 ml(水的密度为1g/cm3);
(2)检测分析:取废水样品98g,恰好与配制的20gNaOH溶液完全反应,试计算废水中硫酸的质量分数。(假设废水中其它成分均不和NaOH反应,反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O).
(1)0.8g;19.2ml (2)1%。
解析试题分析:(1)根据溶质质量等于溶液质量和溶质质量分数的乘积进行分析;
(2)根据 ×100%,求出废水中硫酸的质量分数。
×100%,求出废水中硫酸的质量分数。
解:(1)溶质质量=溶液质量×溶质质量分数=20g×4%=0.8g,所以溶剂质量为:20g-0.8g=19.2g,故需水的体积为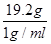 =19.2ml,故需水19.2ml。
=19.2ml,故需水19.2ml。
(2)氢氧化钠的质量=20g×4%=0.8g
设硫酸的质量为x
H2SO4+2NaOH=Na2SO4+2H2O
98 80
x 0.8g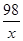 =
=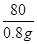
X=0.98g
废水中硫酸的质量分数=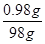 ×100%=1%
×100%=1%
答:废水中硫酸的质量分数为1%。
考点:考查根据化学反应方程式的计算;有关溶质质量分数的简单计算

练习册系列答案
相关题目
实验室将10g质量分数为98%的硫酸稀释成10%的稀硫酸,需要水的质量为( )
| A.49g | B.88g | C.98g | D.100g |
自然界有一种含镁矿石,其化学组成可表示为 xMgCO3 ? yMg(OH)2(x、y 为正整数) 。取两份等质量的样品,一份加过量盐酸生成气体8.8g;另一份加热至完全分解得到固体 MgO 的质量为 10g(MgCO3? MgO+CO2↑;Mg(OH)2? MgO+H2O) 。下列x,y 的关系正确的是
| A.x∶y=4∶1 | B.x∶y =1∶4 | C.x∶y=1∶1 | D.x∶y=2∶1 |