题目内容
为了探究铁和硫酸溶液反应中量的关系,兴趣小组做了五组实验,实验结果记录如下:
| 编号 | 加入铁的质量/g | 硫酸溶液体积/mL | 生成氢气的质量/g |
| 1 | 1.12 | 20.0 | 0.04 |
| 2 | x | 20.0 | 0.08 |
| 3 | 3.36 | 20.0 | 0.12 |
| 4 | 4.48 | 20.0 | 0.14 |
| 5 | 5.60 | 40.0 | y |
- A.2.24、0.14
- B.2.24、0.20
- C.3.36、0.16
- D.3.36、0.14
B
分析:铁与硫酸反应时生成硫酸亚铁和氢气,根据反应的化学方程式物质之间的质量比为定值然后据此进行推测或计算.
解答:根据记录可知,硫酸足量的情况下,加入的铁与生成的氢气的质量比为1.12:0.04,分析前三次数据可知,硫酸足量,故第二次加入的质量为2.24g,若硫酸足量,则加入4.48g铁能生成氢气的质量为0.16g,而第四次试验只得到0.14g氢气,说明硫酸量不足,每20mL硫酸最多生成氢气的质量为0.14g,第五次实验时,硫酸的体积为40mL,与5.60g铁反应时硫酸有剩余,应该根据铁的质量求生成氢气的质量,所以生成氢气的质量为: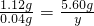 y=0.20g,观察选项,故选B.
y=0.20g,观察选项,故选B.
点评:本题结合金属与酸溶液的反应考查了表格分析,完成此题,关键是找准表格中数据的关系,然后做出推断或计算.
分析:铁与硫酸反应时生成硫酸亚铁和氢气,根据反应的化学方程式物质之间的质量比为定值然后据此进行推测或计算.
解答:根据记录可知,硫酸足量的情况下,加入的铁与生成的氢气的质量比为1.12:0.04,分析前三次数据可知,硫酸足量,故第二次加入的质量为2.24g,若硫酸足量,则加入4.48g铁能生成氢气的质量为0.16g,而第四次试验只得到0.14g氢气,说明硫酸量不足,每20mL硫酸最多生成氢气的质量为0.14g,第五次实验时,硫酸的体积为40mL,与5.60g铁反应时硫酸有剩余,应该根据铁的质量求生成氢气的质量,所以生成氢气的质量为:
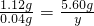 y=0.20g,观察选项,故选B.
y=0.20g,观察选项,故选B.点评:本题结合金属与酸溶液的反应考查了表格分析,完成此题,关键是找准表格中数据的关系,然后做出推断或计算.

练习册系列答案
相关题目
(2012?高淳县二模)为了探究铁和硫酸溶液反应中量的关系,兴趣小组做了五组实验,实验结果记录如下:
|
为了探究铁和硫酸溶液反应中量的关系,兴趣小组做了五组实验,实验结果记录如下:
|
编号 |
加入铁的质量/g |
硫酸溶液体积/mL |
生成氢气的质量/g |
|
1 |
1.12 |
20.0 |
0.04 |
|
2 |
x |
20.0 |
0.08 |
|
3 |
3.36 |
20.0 |
0.12 |
|
4 |
4.48 |
20.0 |
0.14 |
|
5 |
5.60 |
40.0 |
y |
则表格中记录的x和y的数值应分别为
A.2.24、0.14 B.2.24、0.20 C.3.36、0.16 D.3.36、0.14
为了探究铁和硫酸溶液反应中量的关系,兴趣小组做了五组实验,实验结果记录如下:
则表格中记录的x和y的数值应分别为( )
A.2.24、0.14
B.2.24、0.20
C.3.36、0.16
D.3.36、0.14
| 编号 | 加入铁的质量/g | 硫酸溶液体积/mL | 生成氢气的质量/g |
| 1 | 1.12 | 20.0 | 0.04 |
| 2 | x | 20.0 | 0.08 |
| 3 | 3.36 | 20.0 | 0.12 |
| 4 | 4.48 | 20.0 | 0.14 |
| 5 | 5.60 | 40.0 | y |
A.2.24、0.14
B.2.24、0.20
C.3.36、0.16
D.3.36、0.14
为了探究铁和硫酸溶液反应中量的关系,兴趣小组做了五组实验,实验结果记录如下:
| 编号 | 加入铁的质量/g | 硫酸溶液体积/mL | 生成氢气的质量/g |
| 1 | 1.12 | 20.0 | 0.04 |
| 2 | x | 20.0 | 0.08 |
| 3 | 3.36 | 20.0 | 0.12 |
| 4 | 4.48 | 20.0 | 0.14 |
| 5 | 5.60 | 40.0 | y |
则表格中记录的x和y的数值应分别为
A.2.24、0.14 B.2.24、0.20 C.3.36、0.16 D.3.36、0.14