题目内容
酸碱盐的用途很广泛.
(1)某生实验操作考试的考题是:用碳酸钠溶液鉴别稀盐酸和澄清石灰水.
[进行实验]
| 操作步骤 | 实验现象 | 实验结论 |
| 分别用A、B两支试管取样,然后各加入适量碳酸钠溶液 | A中______ B中______ | A中的物质是稀盐酸 B中的物质是澄清石灰水 |
[假设与猜想]①NaCl、HCl、Ca(OH)2、Na2CO3;②NaCl、NaOH、Na2CO3;③NaCl、CaCl2、HCl; ④Ca(OH)2、CaCl2、NaOH
[交流讨论]以上猜想合理的有______;不合理的理由是______
[实验与探究]
任选一种合理猜想,设计实验证明,写出实验方案.
(2)已知实验中使用的碳酸钠试剂瓶标签如下:
| 试剂名称 | 碳酸钠溶液 |
| 溶液浓度 | 10% |
②现取出106g Na2CO3溶液,加入过量的盐酸溶液,计算生成气体的质量.
解:(1)[进行实验]:碳酸钠溶液与稀盐酸的化学反应式是:Na2CO3+2HCl=2NaCl+H2O+CO2↑.碳酸钠溶液与石灰水的化学反应式是:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓.
所以,试管A中有气泡冒出,试管B中有沉淀生成;
故填:有气泡冒出;有沉淀生成;
[交流讨论]:根据化学反应原理知,该混合废液中的物质是Na2CO3、HCl、Ca(OH)2、NaOH、NaCl、CaCl2中的几种.因为CO32-与Ca2+、H+不能共存,所以猜想①不合理.
故答案是:②③④;Ca(OH)2与Na2CO3、HCl不能共存,Na2CO3与HCl不能共存.
[实验与探究]选择②进行证明:
食盐水呈中性,使酚酞试液不变色,而碳酸钠和氢氧化钠呈碱性,能使酚酞试液变红色,可用酚酞将食盐水鉴别出来;碳酸钠与盐酸反应产生气泡,氢氧化钠与盐酸反应没有气泡产生,可用盐酸将碳酸钠与氢氧化钠区分开来.
(2)①应称取碳酸钠的质量:150kg×10%=15kg;
②设生成气体的质量为x.
Na2CO3+2HCl=2NaCl+H2O+CO2↑.
106 44
106g x
 =
=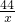 ,
,
解得,x=44g.
答:①要配制150kg这种碳酸钠溶液,应称取碳酸钠的质量是15kg.
②现取出106g Na2CO3溶液,加入过量的盐酸溶液,生成气体的质量是44g.
分析:(1)[进行实验]碳酸钠溶液与石灰水反应有白色沉淀生成;碳酸钠溶液与稀盐酸反应有二氧化碳气体产生;
[交流讨论]Ca(OH)2与Na2CO3不能共存,HCl、Ca(OH)2不能共存,据此判定以上猜想的正确与否;
(2)①根据溶质质量分数=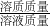 ×100%来计算溶质碳酸钠的质量;
×100%来计算溶质碳酸钠的质量;
②根据化学反应式:Na2CO3+2HCl=2NaCl+H2O+CO2↑,来计算生成气体的质量.
点评:本题考查了常见物质成分的鉴别,完成此题,可以依据已有的物质的性质进行解答.
所以,试管A中有气泡冒出,试管B中有沉淀生成;
故填:有气泡冒出;有沉淀生成;
[交流讨论]:根据化学反应原理知,该混合废液中的物质是Na2CO3、HCl、Ca(OH)2、NaOH、NaCl、CaCl2中的几种.因为CO32-与Ca2+、H+不能共存,所以猜想①不合理.
故答案是:②③④;Ca(OH)2与Na2CO3、HCl不能共存,Na2CO3与HCl不能共存.
[实验与探究]选择②进行证明:
食盐水呈中性,使酚酞试液不变色,而碳酸钠和氢氧化钠呈碱性,能使酚酞试液变红色,可用酚酞将食盐水鉴别出来;碳酸钠与盐酸反应产生气泡,氢氧化钠与盐酸反应没有气泡产生,可用盐酸将碳酸钠与氢氧化钠区分开来.
(2)①应称取碳酸钠的质量:150kg×10%=15kg;
②设生成气体的质量为x.
Na2CO3+2HCl=2NaCl+H2O+CO2↑.
106 44
106g x
 =
=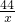 ,
,解得,x=44g.
答:①要配制150kg这种碳酸钠溶液,应称取碳酸钠的质量是15kg.
②现取出106g Na2CO3溶液,加入过量的盐酸溶液,生成气体的质量是44g.
分析:(1)[进行实验]碳酸钠溶液与石灰水反应有白色沉淀生成;碳酸钠溶液与稀盐酸反应有二氧化碳气体产生;
[交流讨论]Ca(OH)2与Na2CO3不能共存,HCl、Ca(OH)2不能共存,据此判定以上猜想的正确与否;
(2)①根据溶质质量分数=
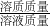 ×100%来计算溶质碳酸钠的质量;
×100%来计算溶质碳酸钠的质量;②根据化学反应式:Na2CO3+2HCl=2NaCl+H2O+CO2↑,来计算生成气体的质量.
点评:本题考查了常见物质成分的鉴别,完成此题,可以依据已有的物质的性质进行解答.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目