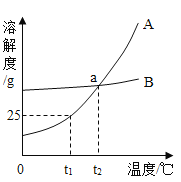
题目内容
【题目】某溶液中可能含有碳酸钠、氯化钾、硫酸钠、硫酸中的一种或几种,为测定其组成,进行如下实验:取样20g,先后逐滴加入氯化钡溶液、稀硝酸,产生沉淀的质量与时间的关系如图所示.
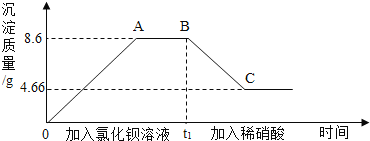
(1)实验中,AB之间图象所对应的溶液中的溶质一定有 .
(2)BC段沉淀减少的原因是 (用化学方程式表示).
(3)由上述实验可知,原溶液中一定含有 ,可能有 .
(4)求原溶液中硫酸钠的质量分数。
【答案】(1)NaCl和BaCl2 (2)BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O (3)一定含有Na2CO3和Na2SO4,可能有KCl (4)14.2%
【解析】
(1)加硝酸之后沉淀质量减少没说明沉淀有两种,分别为硫酸钡沉淀和碳酸钡沉淀,AB之间图象是氯化钡和碳酸钠、硫酸钠反应后过量的情况,因此所对应的溶液中的溶质一定有过量的氯化钡和反应生成的氯化钠;故填:NaCl和BaCl2 。
(2)BC段减少的沉淀是能够溶于稀硝酸的碳酸钡沉淀,而硫酸钡不溶于稀硝酸,所以到C点后沉淀不在减少,化学方程式为:BaCO3+2HNO= Ba(NO3)2+CO2↑+H2O;故填:BaCO3+2HNO= Ba(NO3)2+CO2↑+H2O 。
(3)根据坐标分析沉淀是先增加到A,随着氯化钡的加入,沉淀不再增加,从B点到C点沉淀又逐渐减少,说明沉淀是部分溶解于稀硝酸,因此产生的沉淀既有碳酸钡又有硫酸钡,故原溶液中肯定含有碳酸钠,同时说明没有硫酸,一定含有硫酸钠,可能含有氯化钾故填:Na2CO3和Na2SO4 ;KCl。
(4)设:原溶液中硫酸钠的质量为x。
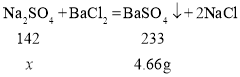
![]()
![]() =2.84g
=2.84g
原溶液中硫酸钠的质量分数=![]()
答:求原溶液中硫酸钠的质量分数14.2%。

【题目】某校化学学习小组准备用生石灰制取氢氧化钠固体,他们进行如下探究过程,请根据他们的探究回答问题。
(查阅资料)
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
NaOH 的溶解度 | 42 | 109 | 129 | 174 | 314 | 147 |
Ca(OH)2 的溶解度 | 0.18 | 0.16 | 0.14 | 0.12 | 0.09 | 0.07 |
(设计实验、制取氢氧化钠)
步骤①:将一定量的生石灰加入一只洁净的烧杯中,加入碳酸钠溶液,充分反应.
步骤②:将所得的混合溶液冷却至室温.
步骤③:将冷却后的混合物过滤、洗涤、干燥得到固体A和溶液B.
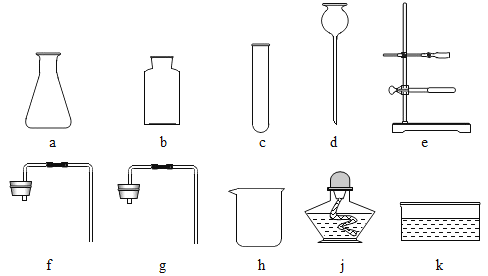
(1)过滤操作中,除烧杯和玻璃棒外,过滤必须用到玻璃仪器是____.
(提出问题、假设猜想)
(2)固体A中的成分是什么?
甲同学认为是:CaCO3.
乙同学认为是:CaCO3和Ca(OH)2.
溶液B中溶质的成分是什么?
丙同学认为是:NaOH
丁同学认为是:NaOH、Ca(OH)2
戊同学认为是:____.
(验证猜想、实验探究)
(3)为了验证各自的猜想,甲、乙同学分别进行了实验:
实验步骤 | 实验现象 | 实验结论 |
甲同学:用一支洁净的试管取少量固体A,再加入过量稀盐酸 | ____ | 自己的猜想正确 |
乙同学:用一支洁净的试管取少量的固体A,加水,充分振荡.向上层清液中滴加 ____ | 上层清液由无色变为红色 | 自己的猜想正确 |
(交流表达、反思评价)
(4)同学们经过讨论后认为,甲同学的实验____(填“能”或“不能”)证明固体A的成分,理由是__,最终同学们确定乙同学的猜想是正确的;
(5)同学们得到的固体A8.7g,加入足量的稀盐酸充分反应后,将溶液加热浓缩、蒸发结晶得到11.1g固体,则固体A中所含的CaCO3的质量是____g;
(6)同学们结合对固体成分的探究,经过讨论确定了丁同学对溶液B的猜想正确,理由是___。
(拓展延伸、巩固提高)
(7)同学们欲将溶液B加热浓缩,加热不久,溶液出现浑浊,只好停止加热,请解释加热时溶液出现浑浊的原因是___,于是,同学们立即变换方案,向B溶液中加入适量的____,过滤,将滤液加热浓缩至饱和,____、过滤、洗涤、烘干得到比较纯净的氢氧化钠固体。