题目内容
【题目】海洋中蕴含着丰富的资源。
(1)海水淡化是解决淡水资源不足的重要方法。下列方法中,可以使海水淡化的是____(填字母序号)。
A.滤纸过滤 B.吸附 C.沉降 D.蒸馏
(2)从海水中提炼出来的重水(D2O)可作原子能反应堆中的减速剂和传热介质。重水中重氢原子(D)的相对原子质量是2,则重水中氧元素的质量分数为_________。
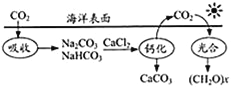
(3)利用海水制取纯碱和金属镁的流程如下图所示,试回答问题:
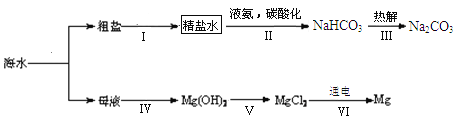
①1926年我国化学家______创立了联合制碱法,促进了世界制碱技术的发展,其第Ⅲ步反应的化学方程式为_________;
②步骤Ⅴ中所加试剂是__________。
【答案】 D 80% 侯德榜 2NaHCO3△ Na2CO3 + H2O + CO2↑ 稀盐酸(HCl)
【解析】(1)海水淡化是解决淡水资源不足的重要方法。使海水淡化的是蒸馏,滤纸过滤和沉淀是除去水中不溶物质,吸附色素和异味。(2) 重水(D2O) 中重氢原子(D)的相对原子质量是2,则重水中氧元素的质量分数为∶![]() ×100%=80%。(3)利用海水制取纯碱和金属镁。①1926年我国化学家侯德榜创立了联合制碱法,促进了世界制碱技术的发展,其第Ⅲ步反应的化学方程式为∶2NaHCO3
×100%=80%。(3)利用海水制取纯碱和金属镁。①1926年我国化学家侯德榜创立了联合制碱法,促进了世界制碱技术的发展,其第Ⅲ步反应的化学方程式为∶2NaHCO3![]() Na2CO3 + H2O + CO2↑。②步骤Ⅴ中所加试剂是稀盐酸(HCl),与氢氧化镁反应生成氯化镁。
Na2CO3 + H2O + CO2↑。②步骤Ⅴ中所加试剂是稀盐酸(HCl),与氢氧化镁反应生成氯化镁。

练习册系列答案
相关题目