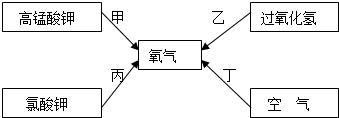
题目内容
果果同学为测定某盐酸中溶质的质量分数,现取该盐酸样品25.0g,向其中加入过量锌粒,完成反应后收集到0.15g氢气,请完成下列计算与分析:
(1)计算该盐酸中溶质的质量分数.
(2)她发现实际测定的结果与盐酸试剂瓶标签上所标的相关信息(浓盐酸、溶质的质量分数为35%)不符合.请你分析的原因可能是 .
(1)计算该盐酸中溶质的质量分数.
(2)她发现实际测定的结果与盐酸试剂瓶标签上所标的相关信息(浓盐酸、溶质的质量分数为35%)不符合.请你分析的原因可能是
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算,酸的物理性质及用途
专题:溶质质量分数与化学方程式相结合的计算
分析:根据生成氢气的质量可以计算盐酸中氯化氢的质量,进一步可以计算该盐酸中溶质的质量分数;
浓盐酸易挥发,如果浓盐酸长时间不用,可能会导致质量分数变小.
浓盐酸易挥发,如果浓盐酸长时间不用,可能会导致质量分数变小.
解答:解:(1)设25g盐酸中氯化氢的质量为x,
Zn+2HCl═ZnCl2+H2↑,
73 2
x 0.15g
=
x=5.475g
该盐酸中溶质的质量分数为:
×100%=21.9%
答:盐酸中溶质的质量分数为21.9%;
(2)浓盐酸具有挥发性,溶质扩散导致溶质质量变小.
故填:浓盐酸具有挥发性,溶质扩散导致溶质质量变小.
Zn+2HCl═ZnCl2+H2↑,
73 2
x 0.15g
| 73 |
| 2 |
| x |
| 0.15g |
x=5.475g
该盐酸中溶质的质量分数为:
| 5.475g |
| 25g |
答:盐酸中溶质的质量分数为21.9%;
(2)浓盐酸具有挥发性,溶质扩散导致溶质质量变小.
故填:浓盐酸具有挥发性,溶质扩散导致溶质质量变小.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,比较简单,计算时要注意规范性和准确性.

练习册系列答案
相关题目
已知反应前后分子变化的微观示意图如下所示.下列说法错误的是( )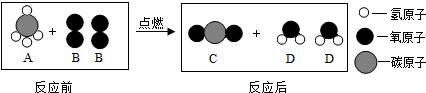

| A、此反应为化合反应 | ||||
| B、此反应为氧化反应 | ||||
| C、点燃前,要先检验A的纯度,防止爆炸 | ||||
D、化学方程式:CH4+2O2
|
下列关于水的说法中正确的是( )
| A、玉林地区的水资源丰富,因此不需要节约用水 |
| B、城市污染不需经过净化处理可以直接排放 |
| C、清澈、透明的泉水是纯净物 |
| D、水资源是宝贵的,一定要节约用水 |
维生素C(C6H8O6)主要存在于蔬菜、水果中,它能促进人体生长发育、增强人体对疾病的抵抗能力,近年科学家还发现维生素C有防癌作用.下列关于维生素C的说法中错误的是( )
| A、维生素C由碳、氢、氧三种元素组成 |
| B、维生素C中C、H、O三种元素的质量比是3:4:3 |
| C、维生素C的相对分子质量是176 |
| D、一个维生素C分子由6个碳原子、8个氢原子、6个氧原子构成 |
 我市某化学兴趣小组的同学用洁净的塑料瓶从釜溪河中取回一定量的水样,然后进行如下研究分析:
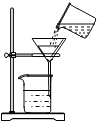
我市某化学兴趣小组的同学用洁净的塑料瓶从釜溪河中取回一定量的水样,然后进行如下研究分析: 保护水土资源人人有责,为了测定一定量黄河水中泥沙的质量,某同学设计了如图所示的实验操作:
保护水土资源人人有责,为了测定一定量黄河水中泥沙的质量,某同学设计了如图所示的实验操作: