题目内容
13 g锌可以跟100 g硫酸溶液恰好完全反应,计算:
(1)可制得氢气多少克?把溶液蒸干,得到多少克硫酸锌?
(2)这种硫酸溶液的溶质质量分数是多少?所得溶液的溶质质量分数是多少?
(3)100 g这种硫酸溶液稀释成10%的硫酸,需加水多少克?
(1)可制得氢气多少克?把溶液蒸干,得到多少克硫酸锌?
(2)这种硫酸溶液的溶质质量分数是多少?所得溶液的溶质质量分数是多少?
(3)100 g这种硫酸溶液稀释成10%的硫酸,需加水多少克?
(1)(2)设可制得的氢气的质量为x,得到的硫酸锌的质量为y,
Zn+H2SO4=ZnSO4+H2↑
65 161 2
13g y x
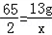 ,
,
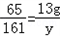
解之得:x=0.4g,
y=32.2g.
参与反应的H2SO4的质量为:32.2g+0.4g﹣13g=19.6g,
这种硫酸溶液的溶质质量分数为: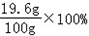 =19.6%;
=19.6%;
所得溶液的溶质质量分数为: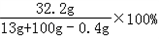 =28.6%.
=28.6%.
答:可制得氢气0.4克,把溶液蒸干,得到32.2克硫酸锌,这种硫酸溶液的溶质质量分数是19.6%,所得溶液的溶质质量分数是28.6%.
(3)19.6g÷10%﹣100g=96g.
Zn+H2SO4=ZnSO4+H2↑
65 161 2
13g y x
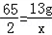 ,
,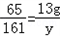
解之得:x=0.4g,
y=32.2g.
参与反应的H2SO4的质量为:32.2g+0.4g﹣13g=19.6g,
这种硫酸溶液的溶质质量分数为:
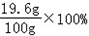 =19.6%;
=19.6%;所得溶液的溶质质量分数为:
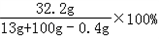 =28.6%.
=28.6%.答:可制得氢气0.4克,把溶液蒸干,得到32.2克硫酸锌,这种硫酸溶液的溶质质量分数是19.6%,所得溶液的溶质质量分数是28.6%.
(3)19.6g÷10%﹣100g=96g.

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目