题目内容
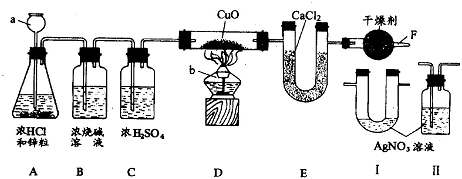
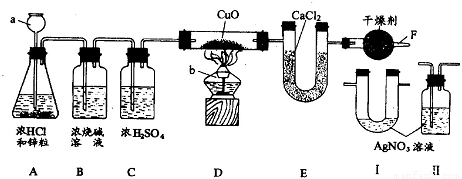
用如图所示实验装置作测定水组成的实验,回答有关问题:
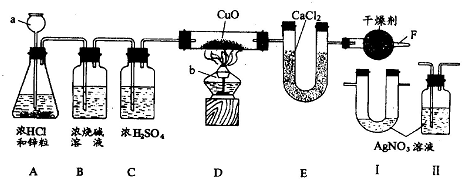
(1)图中仪器 a的名称是
(2)根据精确实验测知,水中氢氧元素的质量比为1:8,试用“<”、“>”或“=”符号回答:
①如果没有C装置,则测得的水中氢氧两种元素的质量比
②如果没有F装置,则测得的水中氢氧两种元素的质量比
(3)为了证明进入D装置玻璃管的H2中不含有HCl,常在

(1)图中仪器 a的名称是
长颈漏斗
长颈漏斗
,仪器b的名称是酒精灯
酒精灯
.(2)根据精确实验测知,水中氢氧元素的质量比为1:8,试用“<”、“>”或“=”符号回答:
①如果没有C装置,则测得的水中氢氧两种元素的质量比
>
>
1:8;②如果没有F装置,则测得的水中氢氧两种元素的质量比
>
>
1:8;(3)为了证明进入D装置玻璃管的H2中不含有HCl,常在
BC
BC
装置之间增加装置Ⅱ
Ⅱ
(选填I或II);为了证明进入D装置玻璃管的H2中不含有水蒸气,常在CD
CD
装置之间增加一个装有无水硫酸铜的干燥管,则新增的两个装置在达到实验目的前提下实验现象是:Ⅱ中无白色沉淀产生;无水CuSO4固体不变色
Ⅱ中无白色沉淀产生;无水CuSO4固体不变色
.分析:(1)熟记常见仪器的名称;(2)根据D装置中质量的减少量就是生成的水中氧元素的质量,根据E装置质量的增加量是生成的水的质量,用水的质量减去氧元素的质量就是氢元素的质量,再进一步进行分析;(3)根据氯化氢溶于水形成盐酸,检验是否含有氯离子即可;根据硫酸铜结合水生成五水硫酸铜考虑.
解答:解:(1)颈比较长的仪器属于长颈漏斗;提供热源的仪器是酒精灯;
(2)①C装置中浓硫酸是除去混在氢气中的水蒸气,如果没有C装置,混在氢气中的水分也进入了E装置,误认为E装置质量的增加量都是氢气和氧化铜反应生成的水,所以该数值就增大了,水的质量多了,计算的氢元素质量就多了,测得水中氢氧两种元素的质量比>1:8;
②如果没有F装置,空气中水分会进入E装置,E装置质量的增加量多了,水的质量多了,计算的氢元素质量就多了,测得水中氢氧两种元素的质量比>1:8;
(3)由于氯化氢溶于水形成盐酸,盐酸中含有氯离子,只要检验溶液中是否含有氯离子就行,检验氯离子用硝酸银溶液,能生成氯化银白色沉淀,由于硝酸银溶液中含有水,所以将该装置必须放在浓硫酸前面,否则除水后又带上水了;所以将Ⅱ放在BC装置之间;通过该装置如果有白色沉淀产生,说明含有氯化氢,没有白色沉淀说明没有氯化氢;由于硫酸铜是白色粉末,与水结合后生成五水硫酸铜,是蓝色,所以用硫酸铜来检验是否有水,因为是证明进入D装置玻璃管的H2中不含有水蒸气,所以装有无水硫酸铜的装置应加在CD之间,如果变蓝色,有水,不变蓝就没有水.
故答案为:(1)长颈漏斗;酒精灯;(2)①>;②>;(3)BC;Ⅱ;CD;Ⅱ中无白色沉淀产生; 无水CuSO4固体不变色.
(2)①C装置中浓硫酸是除去混在氢气中的水蒸气,如果没有C装置,混在氢气中的水分也进入了E装置,误认为E装置质量的增加量都是氢气和氧化铜反应生成的水,所以该数值就增大了,水的质量多了,计算的氢元素质量就多了,测得水中氢氧两种元素的质量比>1:8;
②如果没有F装置,空气中水分会进入E装置,E装置质量的增加量多了,水的质量多了,计算的氢元素质量就多了,测得水中氢氧两种元素的质量比>1:8;
(3)由于氯化氢溶于水形成盐酸,盐酸中含有氯离子,只要检验溶液中是否含有氯离子就行,检验氯离子用硝酸银溶液,能生成氯化银白色沉淀,由于硝酸银溶液中含有水,所以将该装置必须放在浓硫酸前面,否则除水后又带上水了;所以将Ⅱ放在BC装置之间;通过该装置如果有白色沉淀产生,说明含有氯化氢,没有白色沉淀说明没有氯化氢;由于硫酸铜是白色粉末,与水结合后生成五水硫酸铜,是蓝色,所以用硫酸铜来检验是否有水,因为是证明进入D装置玻璃管的H2中不含有水蒸气,所以装有无水硫酸铜的装置应加在CD之间,如果变蓝色,有水,不变蓝就没有水.
故答案为:(1)长颈漏斗;酒精灯;(2)①>;②>;(3)BC;Ⅱ;CD;Ⅱ中无白色沉淀产生; 无水CuSO4固体不变色.
点评:解答本题关键是要知道该装置的设计意图是:D装置中质量的减少量就是生成的水中氧元素的质量,根据E装置质量的增加量是生成的水的质量,用水的质量减去氧元素的质量就是氢元素的质量;知道检验氯化氢气体用硝酸银溶液,验证是否含有水,用无水硫酸铜,看是否变蓝.

练习册系列答案
相关题目
 (2003?松江区二模)某化学兴趣小组用如图所示的装置作有关二氧化碳气体的实验:
(2003?松江区二模)某化学兴趣小组用如图所示的装置作有关二氧化碳气体的实验: