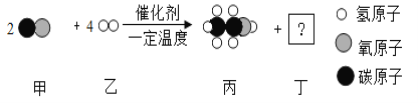
题目内容
【题目】为了防止食品腐败,在许多食品包装盒中都有一包黑色粉末。这种粉末是一种除氧剂。该粉末没有失效时呈黑色,失效后带有红棕色。为了确定该粉末的成分,小明做出了以下的猜想
猜想1:该粉末是木炭粉
猜想2:该粉末是铁粉
猜想3:该粉末是木炭粉和铁粉的混合物
小明取没有失效的该粉末,分别用不同的方法进行如下实验,填写表中空格。
试验操作 | 试验现象 | 猜想是否成立 | |
实验1 | 加入足量的硫酸铜溶液 | 有红色物质析出 | 猜想1:不成立 |
实验2 | 加入足量的稀盐酸 | (1)_____ | 猜想2:成立 |
实验3 | 用磁铁吸引 | 粉末被全部吸引 | (2)猜想3: ________ |
(交流与反思)
(3)根据失效后的颜色判断,该粉末失效的原因是_______ ,变质后得到的红棕色粉末的主要成分是(填物质的化学式)_______ 。
(4)采用什么实验方法可以使失效的粉末“再生”?(用化学方程式表示)________。
(5)写出实验1反应的化学方程式________
【答案】黑色粉末全部溶解,有气泡产生,溶液由无色变为浅绿色 不成立 铁粉生锈 Fe2O3 Fe2O3+3CO![]() 2Fe+3CO2 Fe+CuSO4=Cu+FeSO4
2Fe+3CO2 Fe+CuSO4=Cu+FeSO4
【解析】
(1)铁能与稀盐酸反应生成氢气,故加入足量的稀盐酸观察到的实验现象是黑色粉末全部溶解,有气泡产生,溶液由无色变为浅绿色。
(2)铁粉能被磁铁吸引,碳粉不能被磁铁吸引,用磁铁吸引,粉末被全部吸引,则粉末中含有铁粉,没有碳粉,故猜想3不成立。
(3)根据失效后的颜色判断,该粉末失效的原因是铁粉生锈,变质后得到的红棕色粉末的主要成分是Fe2O3。
(4)使失效的粉末“再生”,即使氧化铁发生化学反应转化为铁,反应的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。
(5)实验1反应的化学方程式为:Fe+CuSO4=Cu+FeSO4。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】为测定硫酸钠和硫酸镁固体混合物中硫酸镁的质量分数。某同学取固体混合物26.2g,向其中加入219.6g水,使其完全溶解配制成混合溶液。将200g一定溶质质量分数的氢氧化钠溶液平均分成5等份,依次加入到上述混合溶液中,生成沉淀的质量与加入氢氧化钠溶液的质量关系如下表:
次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
氢氧化钠溶液质量/g | 40 | 40 | 40 | 40 | 40 |
产生沉淀质量/g | 1.45 | 2.9 | m | 5.8 | 5.8 |
试分析计算。
(1)m的值为_____。
(2)固体混合物中硫酸镁的质量分数。_____(结果保留0.1%)
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数。_____