题目内容
(2012?番禺区一模)研究小组设计分离NaCl和CaCl2混合物样品方案如下
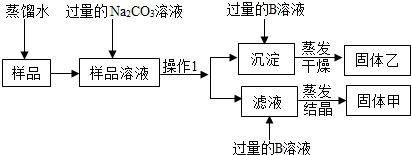
回答下列问题:
(1)固体甲是
(2)“操作1”是
(3)Na2CO3溶液与样品溶液发生反应的化学方程式是
(4)用离子符号表示滤液中含有的离子
(5)过量的B溶液与沉淀发生反应的化学方程式是

回答下列问题:
(1)固体甲是
NaCl
NaCl
.固体乙是CaCl2
CaCl2
.(2)“操作1”是
过滤
过滤
.(3)Na2CO3溶液与样品溶液发生反应的化学方程式是
Na2CO3+CaCl2=2NaCl+CaCO3↓
Na2CO3+CaCl2=2NaCl+CaCO3↓
.(4)用离子符号表示滤液中含有的离子
Na+、Cl-、CO32-
Na+、Cl-、CO32-
.(5)过量的B溶液与沉淀发生反应的化学方程式是
CaCO3+2HCl=CaCl2+CO2↑+H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
.分析:本题属于物质的分离,NaCl和CaCl2混合物样品加入过量的碳酸钠溶液,氯化钠不反应,氯化钙和碳酸钠反应生成碳酸钙白色沉淀和氯化钠,因此操作1是过滤,滤液中有钠离子、氯离子和碳酸根离子;再用稀盐酸除去碳酸根离子,蒸发即可得到氯化钠固体,因此B是盐酸,甲是氯化钠;碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,蒸发干燥得到固体氯化钙,因此乙是氯化钙.
解答:解:(1)滤液中有钠离子、氯离子和碳酸根离子;再用稀盐酸除去碳酸根离子,蒸发即可得到氯化钠固体,因此B是盐酸,甲是氯化钠;碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,蒸发干燥得到固体氯化钙,因此乙是氯化钙.故答案为:NaCl; CaCl2.
(2)碳酸钙是白色沉淀,固体与液体分开用过滤,故答案为:过滤
(3)氯化钙和碳酸钠反应生成碳酸钙白色沉淀和氯化钠,配平即可,故答案为:Na2CO3+CaCl2=2NaCl+CaCO3↓
(4)NaCl和CaCl2混合物样品加入过量的碳酸钠溶液,氯化钠不反应,氯化钙和碳酸钠反应生成碳酸钙白色沉淀和氯化钠,因此操作1是过滤,滤液中有钠离子、氯离子和碳酸根离子;故答案为:Na+、Cl-、CO32-
(5)碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,配平即可,故答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O
(2)碳酸钙是白色沉淀,固体与液体分开用过滤,故答案为:过滤
(3)氯化钙和碳酸钠反应生成碳酸钙白色沉淀和氯化钠,配平即可,故答案为:Na2CO3+CaCl2=2NaCl+CaCO3↓
(4)NaCl和CaCl2混合物样品加入过量的碳酸钠溶液,氯化钠不反应,氯化钙和碳酸钠反应生成碳酸钙白色沉淀和氯化钠,因此操作1是过滤,滤液中有钠离子、氯离子和碳酸根离子;故答案为:Na+、Cl-、CO32-
(5)碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,配平即可,故答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O
点评:本考点属于物质的分离和提纯,是中考的重点也是一个难点,物质的溶解性要记牢,还要加强记忆除去常用离子和特殊离子的方法,从而突破难点.根据物质的溶解性和除杂质的条件,要认真分析,综合把握.本考点经常出现在选择题、填空题和实验题中.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目