题目内容
有一包碳酸钙和氧化钙的混合粉末,取一定量的粉末于烧杯中,向其中加入40g质量分数为7.3%的稀盐酸恰好完全反应,生成气体0.44g,则碳酸钙中的钙元素与氧化钙中的钙元素的质量比为( )
| A、1:1 | B、1:2 |
| C、1:3 | D、1:4 |
考点:根据化学反应方程式的计算,化合物中某元素的质量计算
专题:有关化学方程式的计算
分析:根据气体的质量可以求出碳酸钙的质量和与之反应的氯化氢的质量,再根据与氧化钙反应的氯化氢的质量求出氧化钙的质量,然后分别求出碳酸钙中的钙元素与氧化钙中的钙元素的质量,再求比值.
解答:解:设碳酸钙的质量为x,与碳酸钙反应的氯化氢的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 0.44g
=
=
解得:x=1g,y=0.73g
碳酸钙重钙元素的质量为:1g×
×100%=0.4g;
与氧化钙反应的氯化氢的质量为:40g×7.3%-0.73g=2.19g;
设氧化钙的质量为z
CaO+2HCl=CaCl2+H2O
56 73
z 2.19g
=
z=1.68g
氧化钙中钙元素的质量为:1.68g×
×100%=1.2g;
则碳酸钙中的钙元素与氧化钙中的钙元素的质量比为:0.4g:1.2g=1:3.
故选C.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 0.44g
| 100 |
| x |
| 73 |
| y |
| 44 |
| 0.44g |
解得:x=1g,y=0.73g
碳酸钙重钙元素的质量为:1g×
| 40 |
| 100 |
与氧化钙反应的氯化氢的质量为:40g×7.3%-0.73g=2.19g;
设氧化钙的质量为z
CaO+2HCl=CaCl2+H2O
56 73
z 2.19g
| 56 |
| 73 |
| z |
| 2.19g |
z=1.68g
氧化钙中钙元素的质量为:1.68g×
| 40 |
| 56 |
则碳酸钙中的钙元素与氧化钙中的钙元素的质量比为:0.4g:1.2g=1:3.
故选C.
点评:明确该过程中所发生的反应是正确解决本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
甜蜜素(C6H12NSNa)是一种食品添加剂.下列关于它的说法中,不正确的是( )
| A、甜蜜素是一种混合物 |
| B、甜蜜素由五种元素组成 |
| C、1个 甜蜜素分子含21个原子 |
| D、甜蜜素是化合物 |
下列物质敞口放置一段时间后,因发生化学变化变质,其质量会增大是( )
| A、浓盐酸 | B、浓硫酸 |
| C、食盐(氯化钠) | D、烧碱 |
下列各组都是生活中常见的物质,其中属于同一类物质的一组是( )
| A、红磷 医用酒精 烧碱 |
| B、甲烷 加碘盐 石灰水 |
| C、食醋 液氧 酱油 |
| D、海水 天然气 石油 |
水被烧开时,壶盖被顶起,说明( )
| A、分子是由原子构成的 |
| B、分子的质量很小 |
| C、分子的体积变大 |
| D、分子间空隙增大 |
如图所示实验操作正确的是( )
A、 铁在氧气里燃烧 |
B、 液体的倾倒 |
C、 加热液体 |
D、 滴加液体 |
下列实验操作正确的是( )
| A、稀释浓硫酸时,把水加入浓硫酸 |
| B、用天平称量是左盘放砝码,右盘放药品 |
| C、点燃可燃性气体前,一定要验纯 |
| D、CO还原CuO结束时,先停气、后熄灯 |
下列变化不属于化学变化的是( )
| A、用活性炭净化水 |
| B、铁矿石炼铁 |
| C、植物的光合作用 |
| D、煤气燃烧 |
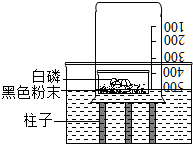 在按书本装置测定空气中氧气含量的实验时,当装置内的氧气低于一定含量时,红磷就不再与氧气反应,从而导致测量结果偏小.有老师对该实验进行了改进,装置如图所示,在一容器中倒入刚拆封的“暖宝宝”黑色粉末,再在上面放足量的白磷,迅速扣上烧杯,随后白磷自燃,利用这一装置可更准确地测定空气中氧气的体积分数.
在按书本装置测定空气中氧气含量的实验时,当装置内的氧气低于一定含量时,红磷就不再与氧气反应,从而导致测量结果偏小.有老师对该实验进行了改进,装置如图所示,在一容器中倒入刚拆封的“暖宝宝”黑色粉末,再在上面放足量的白磷,迅速扣上烧杯,随后白磷自燃,利用这一装置可更准确地测定空气中氧气的体积分数.